
| A. | 提高高锰酸钾的氧化能力,用浓盐酸酸化 | |
| B. | 抑制Fe2+ 的水解,用稀硝酸酸化 | |
| C. | 检验某卤代烃中是否含氯元素,先加HNO3酸化,再加AgNO3溶液检验. | |
| D. | 确认溶液中含有SO42- 时,先用过量盐酸酸化,再加BaCl2溶液检验. |
分析 A.高锰酸钾能氧化氯离子;
B.硝酸具有强氧化性;
C.碱性条件下,将卤代烃水解,产生游离的卤素离子,只直接加硝酸不产生卤素离子;
D.盐酸酸化,排除银离子、碳酸根离子等干扰.
解答 解:A.高锰酸钾能氧化氯离子,则提高高锰酸钾的氧化能力,用硫酸酸化,故A错误;
B.硝酸具有强氧化性,能氧化亚铁离子,则抑制Fe2+的水解,用盐酸或稀硫酸酸化,故B错误;
C.碱性条件下水解,再利用硝酸银检验氯离子,用硝酸酸化,如果生成白色不溶于硝酸的沉淀说明有氯离子的存在,故C错误;
D.盐酸酸化,排除银离子、碳酸根离子等干扰,则确认溶液中含有SO42-时,用盐酸酸化,再检验,故D正确;
故选D.
点评 本题考查氧化还原反应和离子检验,为高频考点,把握发生的氧化还原反应及盐类水解、离子性质为解答的关键,注意离子检验中应排除干扰,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 颜色不同 | B. | 都能使滴有酚酞的NaOH溶液褪色 | ||
| C. | 都能使有色布条褪色 | D. | 加AgNO3溶液都能生成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 第一周期 |  | ||
| 第二周期 |  | 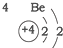 |  |
| 第三周期 | 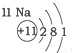 | 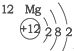 | 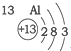 |
| A. | 元素所在的周期数等于其原子的电子层数 | |
| B. | 原子序数与元素原子核电荷数在数值上相同 | |
| C. | 第二、三周期元素的原子从左至右最外层电子数逐渐增多 | |
| D. | 金属元素的原子,其最外层电子数一般少于4个,在化学反应中易得到电子,趋向达到相对稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| B. | 严禁在写作业时将铅笔放入口中啃咬,否则会引起铅中毒 | |
| C. | 工业冶炼铝时电解Al2O3并加入冰晶石(Na3AlF6),是为了降低Al2O3的熔融温度 | |
| D. | 洗衣粉中添加三聚磷酸钠,增强去污的效果 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com