
【题目】以废镍(含NiO,杂质为少量Fe2O3)生产Ni2O3的一种工艺流程如下:
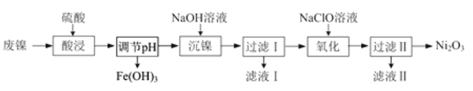
(1)“酸浸”时为了提高酸浸的速率(浸取率),可采取的措施有_____________(任写出一条)。
(2)“酸浸”时Fe2O3发生反应的离子方程式:____________________________________。
(3)“调节pH”使溶液中的Fe3+沉淀完全(离子浓度≤10-5mol·L-1时,离子沉淀完全),则需维持c(OH-)不低于__________ [已知Fe(OH)3的Ksp=4×10-38,![]() ≈1.6 ]。
≈1.6 ]。
(4)“沉镍”的目的是将溶液中的Ni2+转化为Ni(OH)2沉淀,确认Ni2+已经完全沉淀的实验方法是_____________________________________。
(5)“滤液Ⅱ”所含阴离子主要为Cl-,写出“氧化”时反应的离子方程式:____________________。
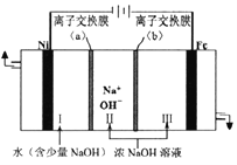
(6)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的![]() 。电解时阳极的电极反应式为___________________________________,离子交换膜(b)为______(填“阴”或“阳”)离子交换膜。
。电解时阳极的电极反应式为___________________________________,离子交换膜(b)为______(填“阴”或“阳”)离子交换膜。
【答案】粉碎或加热或搅拌 或适当增大硫酸浓度 Fe2O3 + 6H+ = 2Fe3+ + 3H2O 1.6×10-11 静置,在上层清液中继续滴加NaOH溶液,无沉淀生成 2Ni(OH)2+ClO-==Ni2O3+Cl-+2H2O Fe-6e-+8OH-==FeO42-+4H2O 阴
【解析】
(1)“酸浸”时为了提高酸浸的速率(浸取率),可采取增大浓度、升高温度、增大接触面积等措施。
(2)“酸浸”时Fe2O3与H+反应,生成Fe3+和水。
(3)c(Fe3+)≤10-5 mol·L-1,利用Ksp[Fe(OH)3]= c(Fe3+)c3(OH-)=4×10-38,即可求出c(OH-)。
(4)“沉镍”的目的是将溶液中的Ni2+转化为Ni(OH)2沉淀,确认Ni2+已经完全沉淀的实验方法是再加碱,看是否有沉淀生成。
(5)“滤液Ⅱ”所含阴离子主要为Cl-,则“氧化”时发生的反应是Ni(OH)2与ClO-反应,生成Ni2O3、Cl-等。
(6)通电后,在铁电极附近生成紫红色的![]() ,则电解时阳极反应为Fe在碱性环境中失电子,生成
,则电解时阳极反应为Fe在碱性环境中失电子,生成![]() 等,由于反应需要消耗OH-,所以离子交换膜(b)应允许OH-通过。
等,由于反应需要消耗OH-,所以离子交换膜(b)应允许OH-通过。
(1)“酸浸”时为了提高酸浸的速率(浸取率),可从增大浓度、升高温度、增大接触面积等方面考虑,即可采取的措施是粉碎(或加热,搅拌,适当增大硫酸浓度等)。答案为:粉碎 或 加热 或 搅拌或 适当增大硫酸浓度;
(2)“酸浸”时Fe2O3与H2SO4发生复分解反应,离子方程式为Fe2O3 + 6H+ = 2Fe3+ + 3H2O。答案为:Fe2O3 + 6H+ = 2Fe3+ + 3H2O;
(3)c(Fe3+)≤10-5 mol·L-1,利用Ksp[Fe(OH)3]= c(Fe3+)c3(OH-)=4×10-38,将c(Fe3+)代入,即可求出c(OH-)≥![]() ×10-11mol/L=1.6×10-11。答案为:1.6×10-11;
×10-11mol/L=1.6×10-11。答案为:1.6×10-11;
(4)“沉镍”的目的是将溶液中的Ni2+转化为Ni(OH)2沉淀,确认Ni2+已经完全沉淀的实验方法是静置,在上层清液中继续滴加NaOH溶液,无沉淀生成。答案为:静置,在上层清液中继续滴加NaOH溶液,无沉淀生成;
(5)“滤液Ⅱ”所含阴离子主要为Cl-,则“氧化”时发生的反应是Ni(OH)2与ClO-反应,生成Ni2O3、Cl-等,反应的离子方程式为2Ni(OH)2+ClO-==Ni2O3+Cl-+2H2O。答案为:2Ni(OH)2+ClO-==Ni2O3+Cl-+2H2O;
(6)通电后,在铁电极附近生成紫红色的![]() ,则电解时阳极反应为Fe在碱性环境中失电子,生成
,则电解时阳极反应为Fe在碱性环境中失电子,生成![]() 等,电极反应式为Fe-6e-+8OH-==FeO42-+4H2O;由于反应需要消耗OH-,所以离子交换膜(b)应允许OH-通过,为阴离子交换膜。答案为:Fe-6e-+8OH-==FeO42-+4H2O;阴。
等,电极反应式为Fe-6e-+8OH-==FeO42-+4H2O;由于反应需要消耗OH-,所以离子交换膜(b)应允许OH-通过,为阴离子交换膜。答案为:Fe-6e-+8OH-==FeO42-+4H2O;阴。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】聚合硫酸铁、明矾可用作净水剂。某课题组拟以废弃的铝铁合金为原料制备聚合硫酸铁和明矾,设计化工流程如下:
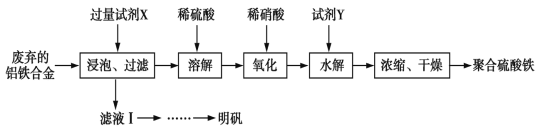
已知:聚合硫酸铁能溶于水,微溶于乙醇,其化学式可表示为[Fe2(OH)x(SO4)y]n。
(1)在聚合硫酸铁中,x、y之间的关系是_______________。试剂X中溶质的化学式为______。
(2)写出上述流程图中的“氧化”的离子方程式:______________该设计存在缺陷,请提出改进意见;________
(3)加入试剂Y的目的是为了调节溶液的pH,若Y为氧化物,写出调节pH的离子方程式:_____
(4)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2 的混合溶液中加入碱液,要使Fe3+ 刚好完全沉淀的pH为____,而Mg2+刚好开始要沉淀的pH为__________。(已知lg 2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是一种极其重要的元素,工业上,生活中到处可见。
(1)碳原子核外有________种能量不同的电子,这些电子占据了______个纺锤形轨道。
(2)下列方法可以比较碳与硫的非金属性强弱的是__________
a.比较原子最外层电子数多少 b.比较其最高价氧化物对应水化物的酸性
c.比较气态氢化物的稳定性 d.比较单质的熔沸点高低
(3)煤的气化是煤高效洁净利用的方向之一。在一定温度下的某容积可变的密闭容器中 建立下列化学平衡:C(s)+H2O(g)![]() CO(g)+H2(g)-Q,可认定该可逆反应在一定条件下已达到化学平衡状态的是_____(选填序号)。
CO(g)+H2(g)-Q,可认定该可逆反应在一定条件下已达到化学平衡状态的是_____(选填序号)。
a.体系的压强不再发生变化 b.v正(CO)=v逆(H2O)
c.生成n molCO的同时生成n mol H2 d.1mol H-H键断裂同时断裂2mol H-O键
(4)若上述化学平衡状态从正反应开始建立,达到平衡后,给平衡体系加压(缩小体积),则容器内气体的平均相对分子质量将______(填写不变、变小、变大、无法确定)。若工业上以此方法生产水煤气,提高产率的措施为____。(写出两条措施)
(5)空气中的CO2浓度增大,会导致温室效应,有人提出将CO2通过管道输送到海底,这可减缓空气中CO2浓度的增加。但长期下去,海水的酸性也将增强,破坏海洋的生态系统。请你结合CO2的性质,从平衡角度分析酸性增强原因 _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸氢铵是我国主要的氮肥品种之一,在贮存和运输过程中容易挥发损失。为了鉴定其质量和确定田间施用量,必须测定其含氮量。
I.某学生设计了一套以测定二氧化碳含量间接测定含氮量的方法。将样品放入圆底烧瓶中:
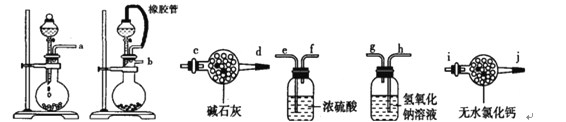
(1)请选择必要地装置,按气流方向连接顺序为________________。
(2)分液漏斗中的液体最适合的是___________。
A.稀盐酸 B.稀硫酸 C.浓硝酸 D.氢氧化钠
(3)连在最后的装置起到的作用____________________________________。
Ⅱ.如果氮肥中成分是(NH4)2SO4,则可以用甲醛法测定含氮量。甲醛法是基于甲醛与一定量的铵盐作用,生成相当量的酸,反应为2(NH4)2SO4+6HCHO→(CH2)6N4 +2H2SO4 + 6H2O,生成的酸再用氢氧化钠标准溶液滴定,从而测定氮的含量。步骤如下:
(4)用差量法称取固体(NH4)2SO4样品0.6g于烧杯中,加入约30mL蒸馏水溶解,最终配成100mL溶液。用________准确取出20.00mL的溶液于锥形瓶中,加入18%中性甲醛溶液5mL,放置5min后,加入1~2滴________指示剂(已知滴定终点的pH约为8.8),用浓度为0.08mol/L氢氧化钠标准溶液滴定,读数如下表:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 1.20 | 16.21 |
2 | 3.00 | 18.90 |
3 | 4.50 | 19.49 |
达滴定终点时的现象为______________________________,由此可计算出该样品中的氮的质量分数为_________________。
(5)在滴定实验结束后发现滴定用的滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,则此实验测定的含氮量比实际值________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁(FeC2O4)作为一种化工原料,可广泛用于新型电池材料、感光材料的生产。以炼钢厂的脱硫渣(主要成分是Fe2O3)为原料生产电池级草酸亚铁晶体的工艺流程如下:

(1)如图是反应温度、加料时间及分散剂的质量分数对草酸亚铁纯度的影响:
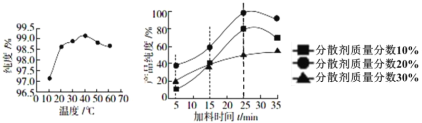
从图象可知,制备电池级草酸亚铁晶体的最佳实验条件是_____________________________
(2)写出“还原”过程中既是化合反应又是氧化还原反应的离子方程式______________________
(3)滤渣2中含有TiOSO4,进行热水解可以生成不溶于水的TiO2·H2O,该反应的化学方程式为___________________________。
(4)流程图中“滤液”经处理后得到一种化肥,其化学式为_________。“一系列操作”指___________。
(5)草酸亚铁固体纯度的测定
①准确称取m g草酸亚铁固体样品,溶于30 mL 2 mol·L-1H2SO4溶液中,在60~80℃水浴加热,用100 mL容量瓶配成100.00 mL溶液。
②取20.00 mL,用KMnO4标准溶液(浓度为c mol·L-1)消耗V1mL。
③向滴定后的溶液中加入适量锌粉,用试剂x检验Fe3+至极微量,过滤,洗涤,洗涤液并入滤液中。
④继续用KMnO4标准溶液(浓度为c mol·L-1)滴定至终点,消耗V2mL。
在②中溶液中发生2MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O,还有另一氧化还原反应,写出其离子方程式_____________,步骤③中检验其中微量的Fe3+的试剂x名称是_________溶液,固体样品的纯度为_____________(用含c、V1、V2的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法对应的离子方程式合理的是
A.纯碱溶液去油污:CO32-+H2O==HCO3-+OH-
B.泡沫灭火器工作原理:2Al3++3CO32-+3H2O==2Al(OH)3↓+3CO2↑
C.铝溶于烧碱溶液:Al+2OH-==AlO2-+H2↑
D.用石墨为电极,电解Pb(NO3)2和Cu(NO3)2的混合溶液制取PbO2时,阳极上发生的电极反应式:Pb2++2H2O-2e-==PbO2+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图。
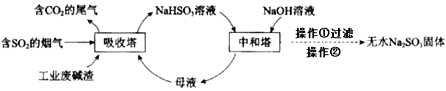
下列说法中不正确的是
A.吸收塔中的温度不宜过高,原因可能是防止SO2的溶解度下降
B.为提高NaHSO3的产率,应控制吸收塔中溶液为弱碱性
C.吸收塔中生成HSO3-的离子方程式是2SO2+CO32-+H2O=2HSO3-+CO2↑
D.操作②为蒸馏水洗涤、干燥,得无水Na2SO3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备金属铝的主要原料。工业上提取铝的工艺流程如下:
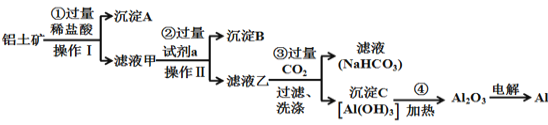
(1)在操作Ⅰ之前先将铝土矿研磨成粉末,目的是:___________________;
(2)沉淀A的化学式是__________;
(3)步骤③中通入过量CO2,产生沉淀C的离子方程式为_________________________;
(4)工业上用电解熔融Al2O3的方法制备金属铝,其反应方程式为____________;
(5)在生活中,常利用Al与Fe2O3间的铝热反应来进行焊接钢轨。除了Fe2O3,铝粉还可以与很多金属氧化物组成铝热剂,下列氧化物中不能与铝粉组成铝热剂的是___________;
a. MgO b. V2O5 c. Fe3O4 d. MnO2
(6)我国首创以铝—空气—海水电池为能源的新型电池,用作海水标志灯已研制成功。该电池以取之不尽的海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流。负极材料是铝,正极材料可以用石墨。写出正极电极反应式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(s)cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )

A. 根据图象无法确定改变温度后平衡移动方向
B. 使用催化剂,C的物质的量分数增加
C. 化学方程式系数a>c+d
D. 升高温度,平衡向逆反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com