
可逆反应:aA(g)+bB(g) cC(g)+dD(g);ΔH=Q,试根据图回答:
cC(g)+dD(g);ΔH=Q,试根据图回答:
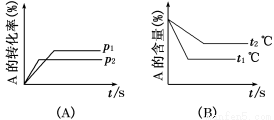
(1)压强p1比p2________(填“大”、“小”)。
(2)(a+b)比(c+d)________(填“大”、“小”)。
(3)温度t1℃比t2℃________(填“高”、“低”)。
(4)Q值是________(填“正”、“负”)。
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源:2014年高中化学鲁科版选修四第1章 化学反应与能量转化练习卷(解析版) 题型:填空题
请按要求回答下列问题。
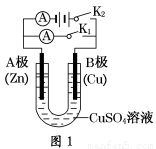
(1)根据图1回答①②:
①若断开K2,闭合K1。
A电极可观察到的现象________________________________________________;
B极的电极反应式为__________________________________________________。
②若断开K1,闭合K2,A电极可观察到的现象是________________;B极的电极反应式为____________。
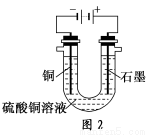
(2)根据图2回答③④:
③将较纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为________________,电解反应的离子方程式为________________。
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积________L。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:选择题
在一定条件下,将64 g二氧化硫气体氧化成三氧化硫气体时,实验测得放出热量为78.64 kJ,已知二氧化硫在此条件下的转化率为80%。下列热化学方程式书写正确的是( )
A.SO2(g)+ O2(g)
O2(g)  SO3(g) ΔH=-98.3 kJ·mol-1
SO3(g) ΔH=-98.3 kJ·mol-1
B.2SO2(g)+O2(g)  2SO3(l)ΔH=-196.6 kJ·mol-1
2SO3(l)ΔH=-196.6 kJ·mol-1
C.SO2(g)+ O2(g)
O2(g)  SO3(g)ΔH=-78.64 kJ·mol-1
SO3(g)ΔH=-78.64 kJ·mol-1
D.2SO2(g)+O2(g)  2SO3(g)ΔH=+196.6 kJ·mol-1
2SO3(g)ΔH=+196.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷(解析版) 题型:选择题
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
从以上表格中判断以下说明不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷(解析版) 题型:填空题
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O 2NH3+O2
2NH3+O2
进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
T/℃ | 30 | 40 | 50 |
生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
请回答下列问题:
(1)50℃时从开始到3 h内以O2物质的量变化表示的平均反应速率为________ mol·h-1。
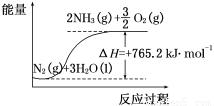
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是____________。
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢。请提出可提高其反应速率且增大NH3生成量的建议:_______________________________________。
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
①该条件下的平衡常数为________;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。反应放出的热量________(填“>”“<”或“=”)92.4 kJ。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷(解析版) 题型:选择题
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)  2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④
C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷(解析版) 题型:选择题
为了探究影响化学反应速率的因素,4位同学分别设计了下列4个实验,其中结论不正确的是( )
A.将大小、形状相同的镁条和铝条与相同浓度、相同温度下的盐酸反应时,两者快慢相同
B.盛有相同浓度双氧水的两支试管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反应快
C.将浓硝酸分别放在冷暗处和强光下,发现强光下的浓硝酸分解得快
D.升高温度,H2O2的分解速率加快,原因是反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题1 化学反应与能量变化练习卷(解析版) 题型:选择题
[双选题]为了避免青铜器生成铜绿,以下方法正确的是( )
A.将青铜器放在银质托盘上
B.将青铜器保存在干燥的环境中
C.将青铜器保存在潮湿的空气中
D.在青铜器的表面覆盖一层防渗透的高分子膜
查看答案和解析>>
科目:高中化学 来源:2014年高中化学人教版选修四第二章 化学反应速率与化学平衡练习卷(解析版) 题型:选择题
设反应①Fe(s)+CO2(g)  FeO(s)+CO(g) ΔH=a kJ/mol,反应②Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH=a kJ/mol,反应②Fe(s)+H2O(g)  FeO(s)+H2(g) ΔH=b kJ/mol,以上两反应的平衡常数分别为K1和K2。在不同温度下,K1、K2的值如下:
FeO(s)+H2(g) ΔH=b kJ/mol,以上两反应的平衡常数分别为K1和K2。在不同温度下,K1、K2的值如下:
T/K | K1 | K2 |
973 | 1.47 | 2.38 |
1 173 | 2.15 | 1.67 |
下列有关叙述正确的是( )
A.b<0
B.在973 K下增大压强,K2增大
C.a>b
D.在常温下反应①一定能自发进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com