
分析 (1)气体(CN)2与Cl2化学性质相似,能与H2反应生成HCN(其水溶液是一种酸,则HCN中为H-CN形式,HCN含有4个共价键,则C与N原子之间形成三键;
(2)CN-水解使KCN溶液显碱性;
(3)由于氰(CN)2的氧化性比溴弱、比碘强,即有氧化性:Cl2>Br2>(CN)2>I2,则还原性:Cl-<Br-<CN-<I-,据此分析.
(4)25℃,0.1mol/LKOH溶液和0.2mol/LHCN溶液等体积混合后得到浓度均为0.05mol/L的KCN和HCN的混合溶液,若溶液最终PH=8,则说明CN-的水解程度大于HCN的电离程度;根据物料守恒和电荷守恒来分析;
(5)根据HCN可以在氧气中燃烧成CO2、H2O和N2的原理设计的酸性原电池中,HCN在负极上放电生成CO2和N2,根据电极方程式的书写来分析.
解答 解:(1)气体(CN)2与Cl2化学性质相似,能与H2反应生成HCN(其水溶液是一种酸,则HCN中为H-CN形式,HCN含有4个共价键,则C与N原子之间形成三键,故HCN的结构式为H-C≡N,故答案为:H-C≡N;
(2)CN-水解CN-+H2O?HCN+OH-,破坏水的电离平衡,使KCN溶液显碱性,故答案为:CN-+H2O?HCN+OH-;
(3)由于氰(CN)2的化学性质与卤素很相似(X2),且氰(CN)2的氧化性比溴弱、比碘强,即有氧化性:Cl2>Br2>(CN)2>I2,则还原性:Cl-<Br-<CN-<I-.
A.氰(CN)2的化学性质与卤素很相似(X2),而卤素与氢氧化钠反应时发生歧化反应,故(CN)2和氢氧化钠溶液反应也发生歧化反应:(CN)2+2NaOH═NaCN+NaCNO+H2O,故A正确;
B.MnO2能将浓HCl氧化制取氯气,而CN-的还原性强于Cl-,故反应MnO2+4HCN═Mn(CN)2+(CN)2+2H2O能发生,故B正确;
C.由于氧化性(CN)2>I2,故I2不能将(CN)2置换出,即反应I2+2KCN═2KI+(CN)2不能发生,故C错误;
D.由于还原性Br-<CN-,故向NaBr(aq)和KCN(aq)中加入少量Cl2,氯气只氧化CN-,故发生反应:Cl2+2NaCN═2NaCl+(CN)2,故D错误.
故选CD.
(4)25℃,0.1mol/LKOH溶液和0.2mol/LHCN溶液等体积混合后得到浓度均为0.05mol/L的KCN和HCN的混合溶液,若溶液最终PH=8,则说明CN-的水解程度大于HCN的电离程度:CN-+H2O?HCN+OH-,HCN?CN-+H+.而pH=8,故C(H+)=10-8mol/L,C(OH-)=10-6mol/L,根据物料守恒可知:C(CN-)+C(HCN)=2C(K+) ①
根据电荷守恒可知:C(CN-)+C(OH-)=C(K+)+C(H+) ②将①②联立可得:C(HCN)-C(CN-)=2C(OH-)-2C(H+)=2×10-6mol/L-2×10-8mol/L=1.98×10-6.
故答案为:小于;相同温度和浓度情况下,HCN电离程度小于CN-的水解程度;1.98×10-6;
(5)由于HCN可以在氧气中燃烧成CO2、H2O和N2,故据此原理设计的酸性原电池中,HCN在负极上放电生成CO2和N2,在此过程中失去电子,结合酸性环境可知负极反应为:2HCN-10e-+4H2O=2CO2+N2+10H+,故答案为:2HCN-10e-+4H2O=2CO2+N2+10H+.
点评 本题依托信息给予题,考查了卤素单质间的置换反应、盐的混合溶液中的离子浓度的计算和大小比较,难度不大,应注意燃料电池中电极方程式的书写方法.


科目:高中化学 来源: 题型:解答题
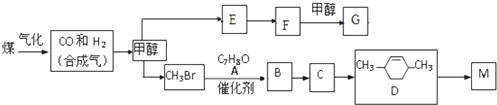
 +RX$\stackrel{催化剂}{→}$
+RX$\stackrel{催化剂}{→}$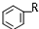 +HX完成下列填空:
+HX完成下列填空: 2HCHO+2H2O.
2HCHO+2H2O.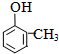 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 制取氨气并完成喷泉实验
制取氨气并完成喷泉实验查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 取酸雨试样,加入10%H2O2溶液,再加入BaCl2溶液,有白色沉淀生成 | 该酸雨试样中一定含有H2SO4 |
| B | 将锌片和银片用导线连接后同时插入盛有稀硫酸的烧杯中,银片表面产生大量气泡 | 形成的原电池中锌作负极,银作正极 |
| C | 某无色溶液,加银氨溶液,水浴加热,有银镜生成 | 溶液中一定含有醛类化合物 |
| D | 配制FeCl2溶液时,先将FeCl2溶于适量稀硝酸,再用蒸馏水稀释,最后在试剂瓶中加入少量的铁粉 | 抑制Fe2+水解,并防止Fe2+被氧化为Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3>NaHCO3 | B. | 碱性:Na2CO3<NaHCO3 | ||
| C. | 水中的溶解度:Na2CO3<NaHCO3 | D. | 与盐酸反应速度Na2CO3>NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 石墨与O2生成CO2的反应是吸热反应 | |
| B. | 金刚石、石墨与O2反应,均可生成具有极性共价键的CO2 | |
| C. | 从能量角度看,金刚石比石墨更稳定 | |
| D. | C(金刚石,s)═C(石墨,s)△H=E3-E1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com