
| A. | 60% | B. | 40% | C. | 24% | D. | 4% |
分析 对于aA(g)+B(g)═C(g)+D(g),保持温度不变.将容器体积扩大10了倍,A 的转化率不变,则说明方程式中反应前后气体的体积不变,则a=1,设B的转化率为x,利用三段式法结合平衡常数为1计算该题.
解答 解:对于aA(g)+B(g)═C(g)+D(g),保持温度不变.将容器体积扩大10了倍,A 的转化率不变,则说明方程式中反应前后气体的体积不变,则a=1,设B的转化率为x,则
A(g)+B(g)═C(g)+D(g)
起始(mol) 2 3 0 0
转化(mol)x x x x
平衡(mol)2-x 3-x x x
$\frac{x×x}{(2-x)(3-x)}$=1,
x=1.2,
则B的转化率为$\frac{1.2}{3}×100%$=40%,
故选B.
点评 本题考查化学平衡的计算,熟悉化学平衡的三段法计算及平衡常数、转化率的计算即可解答,注意各物质的浓度的计算,题目难度中等.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:多选题
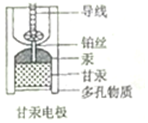 饱和甘汞电极(Hg-Hg2Cl2)因其电动势稳定,常被用作参比电极,其内部构造如图所示,当甘汞电极与锌共同插入ZnCl2溶液中构成原电池时,下列说法正确的是( )
饱和甘汞电极(Hg-Hg2Cl2)因其电动势稳定,常被用作参比电极,其内部构造如图所示,当甘汞电极与锌共同插入ZnCl2溶液中构成原电池时,下列说法正确的是( )| A. | 负极的电极反应式为Zn-2e-═Zn2+ | |
| B. | 正极的电极反应式为Hg2Cl2+2e-═2Hg+2Cl- | |
| C. | 多孔物质相当于盐桥 | |
| D. | 甘汞电极中,Cl-既不是反应物,也不是产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
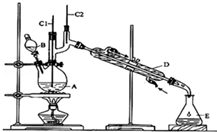 正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.| 沸点/℃ | 密度(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.5 | 0.8107 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
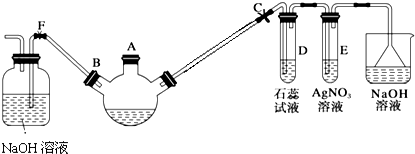
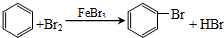 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2g S在反应中转移电子数为0.2NA | |
| B. | 0.1mol Fe在反应中转移电子数为0.3NA | |
| C. | 6.5g Zn在反应中转移电子数为0.2NA | |
| D. | 11.2L O2在反应中转移电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com