
【题目】① NaOH ② CH3COOH ③ NaHCO3 ④ HCl溶液是中学化学中常用的四种物质。
(1)pH相同的CH3COOH和HCl溶液比较,物质的量浓度较大的是____(填序号)。
(2)等体积、等物质的量浓度的CH3COOH和HCl溶液与足量的NaHCO3固体粉末反应,起始反应速率较小的是_______填序号)。
(3)常温下,pH均为10的 NaOH和NaHCO3 溶液,由水电离出的c(OH—)之比为_________________。
(4)常温下,用 0.10 mol/L NaOH溶液滴定 20.00 mL 0.10 mol/L CH3COOH溶液,
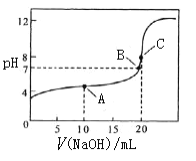
①A点溶质为____________(写化学式),此时c(CH3COO-)_______c(CH3COOH)(填“大于” 、“小于”或“等于”),溶液中水的电离平衡______(填“被抑制”或“被促进”或“无影响”)
②结合化学用语,解释C点pH=8的原因_______________________________________ 。
③下列关于B点的判断正确的是____
a.醋酸和氢氧化钠恰好完全反应
b.混合液中的微粒种类共四种
c.c(CH3COO-) = c(Na+)
【答案】② ② 1:106 CH3COONa、CH3COOH 大于 被抑制 C点20.00mL 0.10mol/LNaOH溶液和20.00mL0.10 mol/LCH3COOH溶液恰好完全反应生成CH3COONa,CH3COO-在溶液中水解CH3COO-+H2O![]() CH3COOH+OH-,使溶液显碱性,溶液pH=8 C
CH3COOH+OH-,使溶液显碱性,溶液pH=8 C
【解析】
(1)pH相同溶液中氢离子浓度相同,醋酸是弱酸部分电离,HCl是强酸完全电离;
(2)与足量的NaHCO3固体粉末反应,起始溶液中氢离子浓度越大,反应速率越快;
(3)氢氧化钠是强碱,电离出的氢氧根抑制水电离,碳酸氢钠是强碱弱酸盐,碳酸氢根在溶液中水解促进水电离;
(4)由图可知,用0.10mol/LNaOH溶液滴定20.00mL0.10 mol/LCH3COOH溶液时,A点为半反应点,得到等浓度的醋酸和醋酸钠混合液,溶液显酸性,B点为中性点,得到的是醋酸和醋酸钠混合液,C点为完全反应点,得到醋酸钠溶液,溶液显碱性。
(1)pH相同的CH3COOH和HCl溶液中氢离子浓度相同,若溶液中氢离子浓度为1mol/L,CH3COOH是弱酸,部分电离,CH3COOH溶液浓度应大于1mol/L;HCl是强酸,完全电离,盐酸溶液浓度为1mol/L,物质的量浓度较大的是CH3COOH溶液,故答案为:②;
(2)等体积、等物质的量浓度的CH3COOH和HCl溶液相比较,HCl溶液中氢离子浓度大于CH3COOH溶液,与足量的NaHCO3固体粉末反应,起始反应速率HCl溶液快、CH3COOH溶液慢,故答案为:②;
(3)氢氧化钠是强碱,电离出的氢氧根抑制水电离,氢氧化钠溶液中水电离出的氢氧根离子浓度等于氢离子浓度,则pH均为10的氢氧化钠溶液中水电离出的c(OH-)=c(H+)=10-10mol/L,碳酸氢钠是强碱弱酸盐,碳酸氢根在溶液中水解促进水电离,溶液中氢氧根离子就是水电离出的氢氧根离子,所以由水电离出的c(OH-)=10-14/10-10mol/L=10-4mol/L,由水电离出的c(OH—)之比为10-10mol/L:10-4mol/L=1:106,故答案为:1:106;
(4)由图可知,用0.10mol/LNaOH溶液滴定20.00mL0.10 mol/LCH3COOH溶液时,A点为半反应点,得到等浓度的醋酸和醋酸钠混合液,溶液显酸性,B点为中性点,得到的是醋酸和醋酸钠混合液,C点为完全反应点,得到醋酸钠溶液,溶液显碱性。
①用0.10mol/LNaOH溶液滴定20.00mL0.10 mol/LCH3COOH溶液时,A点为半反应点,得到等浓度的醋酸和醋酸钠混合液,溶液显酸性,说明醋酸电离大于醋酸根水解,c(CH3COO-)大于c(CH3COOH),醋酸电离出的氢离子抑制水的电离,故答案为:CH3COONa、CH3COOH;大于;被抑制;
②用0.10mol/LNaOH溶液滴定20.00mL0.10 mol/LCH3COOH溶液时,C点为完全反应点,得到醋酸钠溶液,醋酸根在溶液中水解CH3COO-+H2O![]() CH3COOH+OH-,使溶液显碱性,溶液pH=8,故答案为:C点20.00mL 0.10mol/LNaOH溶液和20.00mL0.10 mol/LCH3COOH溶液恰好完全反应生成CH3COONa,CH3COO-在溶液中水解CH3COO-+H2O
CH3COOH+OH-,使溶液显碱性,溶液pH=8,故答案为:C点20.00mL 0.10mol/LNaOH溶液和20.00mL0.10 mol/LCH3COOH溶液恰好完全反应生成CH3COONa,CH3COO-在溶液中水解CH3COO-+H2O![]() CH3COOH+OH-,使溶液显碱性,溶液pH=8;
CH3COOH+OH-,使溶液显碱性,溶液pH=8;
③a、用0.10mol/LNaOH溶液滴定20.00mL0.10 mol/LCH3COOH溶液时,B点为中性点,得到的是醋酸和醋酸钠混合液,故错误;
b、醋酸和醋酸钠混合液中存在的微粒有H2O和CH3COOH两种分子,Na+、CH3COO-、OH-和H+四种离子,故错误;
c、醋酸和醋酸钠混合液中存在电荷守恒关系:c(Na+)+ c(H+)= c(CH3COO-)+c(OH-),由于中性溶液中c(H+)=(OH-),则c(CH3COO-) = c(Na+),故正确;
故选c,故答案为:c。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元
酸HA,溶液pH的变化曲线如图所示。下列说法正确的是

A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. a、b两点所示溶液中水的电离程度相同
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有CO和CO2的混合气体20克,其在标准状况下的体积为11.2L。据此回答下列问题:
(1)该混合气体总的物质的量为______,其平均摩尔质量为_______。
(2)混合气体中碳原子的个数为________。(用NA表示阿伏加德罗常数的值)
(3)若将该混合气体全部通过下图装置进行实验。

则:①气球中收集的气体是______,其质量为_______ 克
②从A瓶中获得沉淀质量的操作是_____、称量。
③若要证明A瓶溶液中的阳离子是否沉淀完全,其方法为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,取浓度均为0.2mol·L-1的醋酸溶液和氨水溶液各10 mL,分别用0.1 mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是 ( )
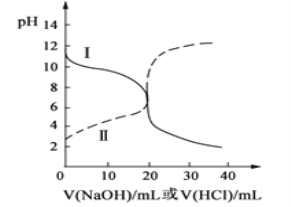
A. 曲线Ⅰ:滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B. 曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C. 曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
D. 曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C(s) + H2O(g) ![]() CO(g) +H2(g) △H=+131.3 kJ·mol-1。
CO(g) +H2(g) △H=+131.3 kJ·mol-1。
(1)该反应的平衡常数K随温度的升高而___________(选填“增大”“ 减小”或“不变”)
(2)上述反应达到平衡后,将体系中的C(s)部分移走,平衡____________(选填“向左移”“向右移”或“不移动”)。
(3)下列事实能说明该反应在一定条件下已达到平衡状态的有___________(填序号)。
A.单位体积内每消耗1 mol CO的同时生成1molH2
B.混合气体总物质的量保持不变
C.生成H2O(g)的速率与消耗CO的速率相等
D.H2O(g)、CO、H2的浓度相等
(4)某温度下,将4.0 mol H2O(g)和足量的炭充入2 L的密闭容器中,发生如下反应,C(s)+ H2O(g) ![]() CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为_____。
CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为_____。
(5)己知:① C(s)+H2O(l) =CO(g)+H2(g) △H1
② 2CO(g)+O2(g)=2CO2 (g) △H2
③ H2O (l)=H2 (g)+1/2 O2 (g) △H3
则C(s)+O2 (g)=CO2 (g)的△H=_____________________。
(6)若设计以一氧化碳为燃料的碱性燃料电池,则正极为通入_______(填化学式)的一极,其电极反应式是:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,常温下,有氧化还原反应(未配平):HFeO4-+(NH2)2CS+H2O→Fe(OH)3+(NH2)2CO+SO42-+OH,下列有关说法正确的是
A. HFeO4-为还原剂,Fe(OH)3为氧化产物
B. 氧化剂与还原剂反应的物质的量之比为4∶3
C. 随着反应的进行,溶液中c(H+)/Kw逐渐变小
D. 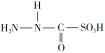 为此反应的中间产物,其中碳元素的化合价为0价
为此反应的中间产物,其中碳元素的化合价为0价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种化合物是很多表面涂层的重要成分,其结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,只有X、Y在同一周期,Y无最高正价,Z的含氧酸均具有氧化性,下列有关说法正确的是
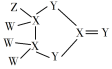
A. WZ沸点高于W2Y的沸点
B. 含Z的两种酸反应可制得Z的单质
C. W2Y2是由极性键和非极性键构成的非极性分子
D. X的含氧酸一定为二元弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于某些离子的检验及结论一定正确的是
A. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO![]()
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO![]()
C. 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH![]()
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案正确且能达到实验目的的是( )
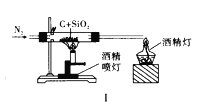
A. 图Ⅰ比较碳、硅两元素非金属性的强弱
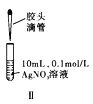
B. 图Ⅱ先滴加5滴![]() 的
的![]() 溶液,再滴加5滴
溶液,再滴加5滴![]() 的
的![]() 溶液。比较
溶液。比较![]() 与
与![]() 溶解度的大小
溶解度的大小
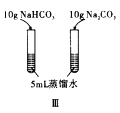
C. 图Ⅲ已知溶解度(20℃)![]() :
:![]() ;
;![]() :
:![]() 。室温下,比较
。室温下,比较![]() 和
和![]() 溶解度的大小
溶解度的大小
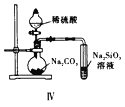
D. 图Ⅳ证明碳酸的酸性比硅酸强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com