
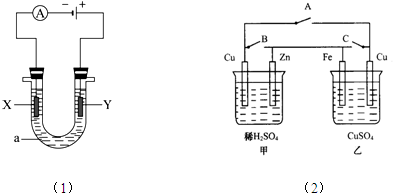
分析 (1)电解饱和食盐水时,阳极上是氯离子失电子,阴极上是氢离子得电子,氯气能使湿润的碘化钾淀粉试纸变蓝;
(2)①当A键断开,B、C闭合时,乙池中铁与电解质溶液硫酸铜发生自发的氧化还原反应,所以乙是原电池;
②当A、C两键断开,B闭合时,乙中铁极发生反应为:Fe+Cu2+=Cu+Fe2+,56g铁被氧化,铁极增重64-56=8g,所以增重1.6g,则被氧化的铁是1.12g;
③将乙中两极都换成石墨,硫酸铜溶液换H2SO4后断开B、C两键,闭合A键,含有最活泼金属的锌的装置为原电池,另一个池是电解池,乙池是电解水,根据整个电路转移电子数相等,得到关系式2molZn~4e-~3mol气体,分析求解.
解答 解:(1)①总的电解方程式为:2 H2O+2NaCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH,和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红,
故答案为:2 H2O+2NaCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH;放出气体,溶液变红;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,氯气能使湿润的碘化钾淀粉试纸变蓝,可以用于氯气的检验,
故答案为:把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色;
③2 H2O+2NaCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH,转移2mol电子,两共生成2mol电子,当导线中有0.1mol的电子通过时,在标况下理论上两极可收集的气体的体积是0.1mol×22.4L/mol=2.24 L,故答案为:2.24 L;
(2)①当A键断开,B、C闭合时,乙池中铁与电解质溶液硫酸铜发生自发的氧化还原反应,所以乙是原电池,故答案为:原电;
②当A、C两键断开,B闭合时,乙中铁极发生反应为:Fe+Cu2+=Cu+Fe2+,56g铁被氧化,铁极增重64-56=8g,所以增重1.6g,则被氧化的铁是1.12g,
故答案为:1.12g;
③将乙中两极都换成石墨,硫酸铜溶液换H2SO4后断开B、C两键,闭合A键,含有最活泼金属的锌的装置为原电池,另一个池是电解池,乙池是电解水,根据整个电路转移电子数相等,得到关系式2molZn~4e-~3mol气体,n(Zn)=$\frac{6.5g}{65g/mol}$=0.1mol,所以生成气体体积为:V=$\frac{0.1×22.4×1{0}^{3}}{2}$=3360mL,故答案为:电解池;3360.
点评 本题考查原电池原理,为高频考点,侧重于学生的分析能力的考查,本题涉及电极反应式的书写、检验等知识点,知道离子放电顺序及电极反应式的书写方法,题目难度不大.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | 0 | ||||||
| ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 2He | ||
| 1 | A | |||||||
| 2 | B | C | D | |||||
| 3 | E | F | G | H | I | J | K | L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据反应:Zn+CuSO4=ZnSO4+Cu,选择适宜的材料和试剂设计一个原电池,完成下列问题:
根据反应:Zn+CuSO4=ZnSO4+Cu,选择适宜的材料和试剂设计一个原电池,完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
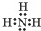 ;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.
;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
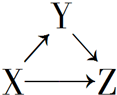 X、Y、Z有如图所示的转化关系,则X和Y可能是( )
X、Y、Z有如图所示的转化关系,则X和Y可能是( )| A. | ①②③④ | B. | ①② | C. | ③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯与HCl加成 | |
| B. | 乙烯与Cl2加成 | |
| C. | 乙烷与Cl2按1:2的体积比在光照条件下反应 | |
| D. | 乙烯先与HCl加成,再与等物质的量的Cl2在光照下反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去瓷器表面污垢可以选用热的烧碱溶液 | |
| B. | 溶质质量分数:医用酒精>食醋>生理盐水 | |
| C. | 绚丽缤纷的烟花是因添加了钾、钠、钙、铜等金属元素的焰色反应形成的 | |
| D. | 研制开发燃料电池汽车,降低机动车尾气污染,某种程度上可以减少PM2.5污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com