
【题目】根据所学知识完成题目:
(1)相同质量的CO 和CO2 所含分子的数目之比为 , 原子的物质的量之比为 , 在同温同压下气体的体积之比是 .
(2)100mL Al2(SO4)3 溶液中c(SO42﹣)=0.9mol/L,则c(Al3+)=mol/L,n[Al2(SO4)3]=mol.
(3)已知8g A能与32g B恰好完全反应,生成22gC和一定量D,现将16g A与足量B的混合物充分反应后,生成2mol D和一定量的C,则D的摩尔质量为 .
(4)若1g N2 中含有x个原子,则阿伏加德罗常数NA= . (用所给数字及符号填空)
(5)将钠和铝的混合物0.2mol溶于足量的盐酸中,产生3136mL(标准状况)氢气,则钠和铝的物质的量之比为 .
【答案】
(1)11:7;22:21;11:7
(2)0.6;0.03
(3)18g/mol
(4)14x mol﹣1
(5)3:1
【解析】解:(1)根据n= ![]() 可知,相同质量的CO 和CO2 的物质的量之比为44g/mol:28g/mol=11:7,则二者所含分子的数目之比为11:7,含有的原子的物质的量之比为11×2:7×3=22:21,在同温同压下,二者体积之比是11:7,所以答案是:11:7;22:21;11:7;(2)由电荷守恒,溶液中3c(Al3+)=2c(SO42﹣),故c(Al3+)=
可知,相同质量的CO 和CO2 的物质的量之比为44g/mol:28g/mol=11:7,则二者所含分子的数目之比为11:7,含有的原子的物质的量之比为11×2:7×3=22:21,在同温同压下,二者体积之比是11:7,所以答案是:11:7;22:21;11:7;(2)由电荷守恒,溶液中3c(Al3+)=2c(SO42﹣),故c(Al3+)= ![]() ×0.9mol/L=0.6mol/L,Al2(SO4)3的浓度为
×0.9mol/L=0.6mol/L,Al2(SO4)3的浓度为 ![]() ×0.9mol/L=0.3mol/L,硫酸铝物质的量为0.1L×0.3mol/L=0.03mol,所以答案是:0.6;0.03;(3)8gA能与32gB恰好完全反应,生成22gC和一定量D,根据质量守恒D的质量为8g+32g﹣22g=18g,故A、B、C、D按质量比8g:32g:22g:18g=4:16:11:9进行反应,由于B足量,A完全反应,则生成的D的质量为16g×
×0.9mol/L=0.3mol/L,硫酸铝物质的量为0.1L×0.3mol/L=0.03mol,所以答案是:0.6;0.03;(3)8gA能与32gB恰好完全反应,生成22gC和一定量D,根据质量守恒D的质量为8g+32g﹣22g=18g,故A、B、C、D按质量比8g:32g:22g:18g=4:16:11:9进行反应,由于B足量,A完全反应,则生成的D的质量为16g× ![]() =36g,故D的摩尔质量为
=36g,故D的摩尔质量为 ![]() =18g/mol;所以答案是:18g/mol;(4)氮气物质的量为
=18g/mol;所以答案是:18g/mol;(4)氮气物质的量为 ![]() =
= ![]() mol,氮原子物质的量为氮气的2倍,则
mol,氮原子物质的量为氮气的2倍,则 ![]() mol×2×NA=x,故NA=14x mol﹣1 , 所以答案是:14x mol﹣1;(5)氢气物质的量为
mol×2×NA=x,故NA=14x mol﹣1 , 所以答案是:14x mol﹣1;(5)氢气物质的量为 ![]() =0.15mol,设Na、Al物质的量分别为xmol、ymol,则:
=0.15mol,设Na、Al物质的量分别为xmol、ymol,则: ![]() 解得x=0.15、y=0.05则钠和铝的物质的量之比为0.15mol:0.05mol=3:1,所以答案是:3:1.
解得x=0.15、y=0.05则钠和铝的物质的量之比为0.15mol:0.05mol=3:1,所以答案是:3:1.


科目:高中化学 来源: 题型:
【题目】下列指定化学用语正确的是
A. NaHCO3水解的离子方程式:HCO3-+H2O=CO32-+H3O+
B. Ba(OH)2的电离方程式:Ba(OH)2==Ba2++2OH-
C. NaHSO4的电离方程式:NaHSO4=Na++H++SO42-
D. Na2S水解的离子方程式:S2-+2H2O=H2S+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池具有比能量高、无污染的特点,用下图模拟其工作原理(放电时两电极均有稳定的金属氢氧化物生成),下列有关说法中正确的是( )

A. 放电时,电子由正极通过外电路流向负极
B. 放电时,负极上的电极反应式为:Zn-2e ─+2H2O = Zn(OH)2+2H+
C. 充电时,阴极区溶液的pH减小
D. 充电时,阳极上的电极反应式为:Fe(OH)3-3e ─+5OH ─ = FeO42 ─+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源危机是当前一个全球性问题。请回答下列问题:
(1)下列做法有助于能源“开源节流”的是_____________(填字母)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.减少资源消耗,注重资源的重复使用、资源的循环再生
(2)甲烷是一种优良的气体燃料。已知1g 甲烷完全燃烧生成CO2和H2O(l)过程中,放出55.6kJ 热量,写出表示甲烷燃烧热的热化学方程式:____________________________。
(3)已知稀溶液中,含30g溶质的醋酸溶液与NaOH 溶液恰好完全反应时,放出28.55kJ热量。写出表示醋酸与NaOH 反应的中和热的热化学方程式:___________________。
(4)已知: CH4(g)+2O2(g) =CO2(g)+2H2O(l) △H=-890.3kJmol-1
N2(g)+O2(g) ==2NO(g) △H=+180kJmol-1
CH4 可用于脱硝,其热化学方程式为CH4(g)+4NO(g)==CO2(g)+2N2(g)+2 H2O(l) △H=__________。
(5)如下图是298 K时N2与H2反应过程中能量变化的曲线图,该反应的热化学方程式为:_____________________________。

(6)已知断裂下列化学键需要吸收的能量分别为: H-H a kJmol-1\、H-O b kJmol-1、O=O c kJmol-1,根据有关数据估算氢气与氧气的反应:2H2+O2=2H2O 该反应的△H=_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从化学键的角度看化学反应的实质是“旧化学键的断裂,新化学键的形成”下列既有旧化学键的断裂,又有新化学键的形成的变化( )
A. 酒精溶于水 B. 水冻成冰
C. 氯化钠受热熔化 D. 氧化钙作为干燥剂吸水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀或气体的物质的量。下列反应对应的曲线错误的是( )

A. 向NaAlO2溶液中滴入HCl至过量
B. 向澄清石灰水中通入CO2至过量
C. 向Na2CO3溶液中滴入盐酸至过量
D. 向含有等物质的量的KOH、Ba(OH)2的混合溶液中通入CO2至沉淀消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,在如下密闭容器中(中间隔板可自由移动)左边充入amolSO2,bmolO2;右边充入cmolSO2、dmolO2,达平衡时如图,此时向两边各充入1mol氦气,则一段时间后重新达平衡,两边容器中SO2的转化率与原平衡相比较

A. 左增大,右减少 B. 左减小,右增大
C. 都不变 D. 都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把在空气中久置的铝片5.0g投入盛有50mL 0.1molL﹣1盐酸溶液的烧杯中,该铝片与盐酸反应,产生氢气的速率v(H2)与反应时间t的关系,可用如图所示的坐标曲线来表示,下列推论错误的是( ) 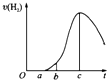
A.O→a段不产生氢气是因为表面的氧化物隔离了铝和稀盐酸
B.b→c段产生氢气的速率增加较快的主要原因之一是温度升高
C.t=c时刻,反应处于平衡
D.t>c时,产生氢气的速率降低的主要原因是溶液中H+浓度下降
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com