
【题目】Ⅰ.某温度时,在一个10 L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。
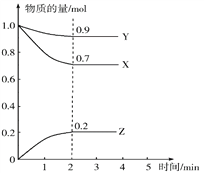
根据图中数据填空:
(1)该反应的化学方程式为_________________________________。
(2)反应开始至2 min,以气体Z表示的平均反应速率为____________________。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色。
(1)一定能证明2SO2(g)+O2(g) ![]() 2SO3(g)达到平衡状态的是__________(填序号,下同)。
2SO3(g)达到平衡状态的是__________(填序号,下同)。
(2)一定能证明I2(g) +H2(g) ![]() 2HI(g)达到平衡状态的是___________。
2HI(g)达到平衡状态的是___________。
【答案】 3X+Y ![]() 2Z 0.01 mol/(L·min) ①③④ ⑤
2Z 0.01 mol/(L·min) ①③④ ⑤
【解析】Ⅰ.根据图象知,随着反应进行,X、Y的物质的量减少而Z物质的量增大,说明X、Y是反应物而Z是生成物。
(1)达到平衡状态时,参加反应的△n(X)=(1.0-0.7)mol=0.3mol、△n(Y)=(1.0-0.9)mol=0.1mol、△n(Z)=(0.2-0)mol=0.2mol,同一反应中同一时间段内参加反应的各物质的物质的量之比等于其计量数之比,所以X、Y、Z的计量数之比=0.3mol:0.1mol:0.2mol=3:1:2,所以该反应方程式为3X+Y2Z,故答案为:3X+Y2Z;
(2)Z的平均反应速率=![]() =
=![]() =0.01mol/(L·min),故答案为:0.01mol/(L·min);
=0.01mol/(L·min),故答案为:0.01mol/(L·min);
Ⅱ.(1)对于反应2SO2(g)+O2(g)2SO3(g),①混合气体的压强,说明气体的物质的量不变,反应达平衡状态,故正确;②混合气体的密度一直不变,故错误;③混合气体的总物质的量不变,反应达平衡状态,故正确;④混合气体的平均相对分子质量,说明气体的物质的量不变,反应达平衡状态,故正确;⑤混合气体的颜色一直不变,反应达平衡状态,故错误;⑥只要反应发生就有各反应物或生成物的反应速率之比等于化学计量数之比,故错误;故选:①③④;
(2)对于反应I2(g)+H2(g)2HI(g),①混合气体的压强一直不变,故错误;②混合气体的密度一直不变,故错误;③混合气体的总物质的量一直不变,故错误;④混合气体的平均相对分子质量一直不变,故错误;⑤混合气体的颜色说明碘蒸气的浓度不变,反应达平衡状态,故正确;故选:⑤。


科目:高中化学 来源: 题型:
【题目】已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
下图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是 ( )
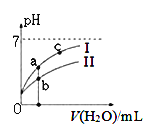
A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+) > c(ClO-)> c(CH3COO-)> c(OH-)> c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为: ClO-+CO2+ H2O =HClO+CO32-
C. 图像中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D. 图像中a点酸的总浓度大于b点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A. 标准状况下,11.2L的戊烷所含的分子数大于0.5NA
B. 28g乙烯所含共用电子对数目为4NA
C. 标准状况下,11.2L二氯甲烷所含分子数为0.5NA
D. 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A2(g)+B2(g) →2AB(g)的能量变化如图所示,叙述正确的是
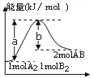
A. 该反应是放热反应
B. 加入催化剂,(b-a)的差值减小
C. 每生成2molAB分子吸收bkJ热量
D. 若反应生成AB为液态,吸收的热量小于(a-b)kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤:
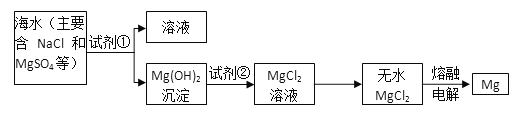
试回答下列问题:
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用__________________________;
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是____________________;
(3)试剂②可以选用_______;反应的离子方程式为:__________________________;
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,写出该反应的化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧产生的SO2是引起酸雨的原因之一。
(1)每隔一定时间测定某处雨水样品的pH值:
![]()
雨水样品pH值变小的主要原因是____________________。
(2)反应2SO2(g)+O2(g)![]() 2SO3(g)+Q (Q>0),其化学平衡常数表达式_______;升高温度,K____________(填“变大”或者“变小”)。
2SO3(g)+Q (Q>0),其化学平衡常数表达式_______;升高温度,K____________(填“变大”或者“变小”)。
(3)判断已达到化学平衡状态的描述是______(选填编号)。
a.体系的压强不再发生变化 | b.2υ正(SO2)=υ逆(O2) |
c.c(SO2) = c(SO3) | d.气体总质量不再变化 |
(4)防治酸雨常用的措施:向煤中加石灰,减少 SO2的产生。这种煤燃烧后,大部分硫元素最终转化为固体盐是_____________。
(5)把CO2气体通入澄清的石灰水,立即会产生浑浊,但把SO2气体通入澄清的石灰水,却不容易看到浑浊,而CaCO3和CaSO3都是难溶的电解质,试说明原因:_____________________。
(6)Na2SO3溶液呈碱性,可吸收尾气SO2。Na2SO3溶液呈碱性的原因(用离子方程式表示)_____________________;常温下,0.1mol/L该溶液中离子浓度由大到小排列___________(用离子符号表示)。
(7)常温下,NaHSO3溶液呈酸性,在Na2SO3溶液中滴加稀盐酸至中性时,溶质的主要成分有__________________。(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬季是雾霾大气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(l)工业上利用甲烷催化还原NOx可减少氮氧化物的排放。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为__________________。
(2)将CO2转化为甲醇可以实现废物利用,达到节能减排的目的,反应原理可表示为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
①在一恒温恒容密闭容器中充入1molCO2和3molH2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。请回答:
0~3min内氢气的平均反应速率为______mol/(L·min);
第10min后,保持温度不变,向该密闭容器中再充入1molCO2(g)和3molH2 (g),则达到平衡时CH3OH的体积分数_________(填“增大”、“减小”或“不变”)。

②取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇的反应的△H3___0(填“>”、“<”或“=”)。
(3)二甲醚也是清洁能源,用合成气在催化剂存在下制备二甲醚的反应原理为:
2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率σ随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率σ随温度、投料比![]() 的变化曲线如图3所示。
的变化曲线如图3所示。
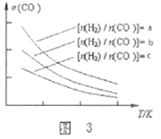
①a、b、c按从大到小的顺序排序为___________。
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应平衡常数的表达式Kp=________________。
③在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是______。
A.逆反应速率先增大后减小B.混合气体的密度增大
C.化学平衡常数K值减小D.氢气的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接甲醇燃料电池以其供电量大、持续时间长而极具发展前景,其工作原理如右图。下列关于它的说法正确的是
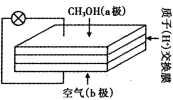
A. 电子自b极经外电路流向a极
B. b极的电极反应式为O2 +4e - +4H+= 2H2O
C. 质子交换膜中的H+流向a极
D. 用该电池电解CuSO4溶液,理论上每生成0.1 molCu消耗氧气1.12 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com