
| A. | 1molNa2O2晶体中阴离子的个数为2NA | |
| B. | 标准状况下,2.24L苯所含的分子总数为0.1NA | |
| C. | 32gO2和32g O3的所含的氧原子数都是为2NA | |
| D. | 6.4g铜与过量的浓硝酸完全反应转移的电子数是0.1NA |
分析 A.Na2O2中含有的阴离子为过氧根离子;
B.标况下,苯为液体;
C.依据N=$\frac{m}{M}$×NA计算;
D.铜与浓硝酸反应生成铜离子,6.4g铜的物质的量为0.1mol,完全反应转移了0.2mol电子.
解答 解:A.1molNa2O2晶体中阴离子的个数为NA,故A错误;
B.标况下,苯为液体,不能使用气体摩尔体积,故B错误;
C.氧气和臭氧都是由氧原子构成,32gO2和32g O3的所含的氧原子数都等于$\frac{32g}{16g/mol}$×NA=2NA,故C正确;
D.6.4g铜的物质的量为:$\frac{6.4g}{64g/mol}$=0.1mol,0.1mol铜与足量浓硝酸反应生成0.1mol铜离子,失去了0.2mol电子,转移的电子数是0.2NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的应用,掌握标况下气体摩尔体积的使用条件,明确物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的转化关系即可解答,注意过氧化钠的结构.


科目:高中化学 来源: 题型:解答题


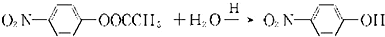 +CH3COOH.
+CH3COOH.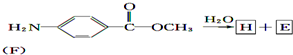
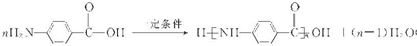 .
. 结构.
结构. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO3、NO3-、BF3都是平面三角型 | B. | P4、CS2、PH3都是非极性分子 | ||
| C. | 金刚石、石墨、SiC都是原子晶体 | D. | 第一电离能:N>O>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
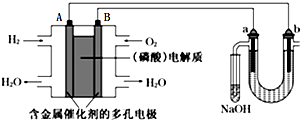
| A. | 电池工作时,B极反应式为O2+2H2O+4e-=4OH- | |
| B. | 电解时,电子流动路径是:A极→外电路→b极→溶液→a极→B极 | |
| C. | NaOH溶液充分吸收后所得溶液可制作漂白水 | |
| D. | 当电池中消耗2.24L(标准状况)H2时,a极周围也会产生2.24L(标准状况)气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
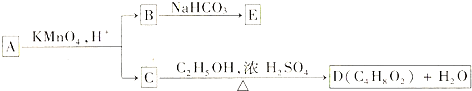
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖氯化钠注射液--用于补充热能和体液 | |
| B. | 二氧氯(ClO2)或漂白粉--利用其氧化性对居所和饮用水消毒 | |
| C. | 络合碘--碘化钾的水溶液,可以用于皮肤和粘膜的消毒 | |
| D. | 电池--通常选用干电池,用于小功率电器的供电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 | |
| B. | 日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 | |
| C. | 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 | |
| D. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是单晶硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该溶液中氢离子的浓度:c(H+)=1×10-11 mol•L-1 | |
| B. | pH=7 的NH4Cl和NH3•H2O的混合溶液:c(Cl-)>c(NH4+)>c(H+)=c(OH-) | |
| C. | 浓度均为0.1 mol•L-1的NH3•H2O和NH4Cl溶液等体积混合后的碱性溶液中:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+) | |
| D. | 0.1 mol•L-1的氨水与0.05 mol•L-1的 H2SO4溶液等体积混合后所得溶液中:2c(NH4+)+2c(NH3•H2O)=c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇与浓氢溴酸反应:CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O | |
| B. | 溴乙烷与氢氧化钠溶液共热:CH3CH2Br+NaOH$→_{△}^{水}$CH3CH2OH+NaBr | |
| C. | 苯酚钠中通入二氧化碳:2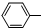 ONa+CO2+H2O→2 ONa+CO2+H2O→2 OH+Na2CO3 OH+Na2CO3 | |
| D. | 淀粉在稀硫酸作用下水解:(C6H10O5)n(淀粉)+nH2O$→_{△}^{稀硫酸}$nC6H12O6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com