
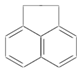
 某有机物结构式如图所示,其一氯代物共有(不考虑立体异构)( )
某有机物结构式如图所示,其一氯代物共有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 7种 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
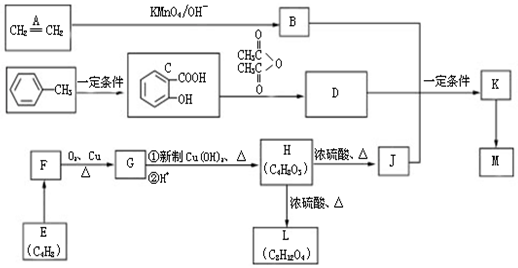

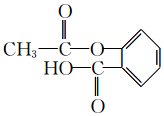 .
.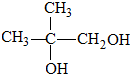 ,H→J的反应类型消去反应.
,H→J的反应类型消去反应. .
.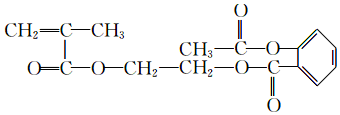 .
. .
. 或
或 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl的电子式: | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | CO2的分子模型示意图: | D. | O2-的离子结构示意图: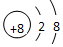 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 40℃时,将35 g NaCl溶于100 g水中,降温至0℃时,可析出晶体 | |
| B. | 20℃饱和KNO3溶液的溶质质量分数>31.6% | |
| C. | a点KNO3和NaCl溶液的物质的量浓度相等 | |
| D. | 固体KNO3中混有NaCl,可用重结晶进行提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| B. | MgO$\stackrel{H_{2}SO_{4}}{→}$MgSO4(aq)$\stackrel{电解}{→}$Mg | |
| C. | 饱和NaCl(aq)$\underset{\stackrel{①N{H}_{3}}{→}}{②C{O}_{2}}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| D. | NH3$→_{催化剂,△}^{O_{2}}$NO$\stackrel{H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硫化亚铁中加入稀硫酸 2H++S2-→H2S↑ | |
| B. | 向苯酚钠溶液中通入少量的CO2 -O-+CO2+H2O→ -O-+CO2+H2O→ -OH+HCO3- -OH+HCO3- | |
| C. | 向碳酸氢钠溶液中滴入少量石灰水 HCO3-+Ca2++OH-→CaCO3↓+H2O | |
| D. | 向明矾溶液中加入过量的氨水 A13++3NH3•H2O→Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com