
A、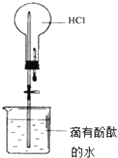 打开止水夹,烧瓶内出现红色喷泉 |
B、 酸性KMnO4溶液中出现气泡,颜色无明显变化 |
C、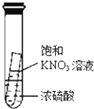 静置一段时间,小试管内有晶体析出 |
D、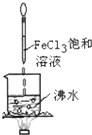 烧杯中液体变为红褐色后,继续加热煮沸,会出现浑浊 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等 |
| B、等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等 |
| C、常温常压下28 g CO与22.4 L O2所含分子数相等 |
| D、16 g CH4与18 g NH所含质子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所含碳原子数比为1:1 |
| B、体积比为11:7 |
| C、密度比为7:11 |
| D、分子数比为7:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
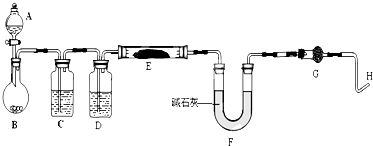
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在稀硫酸中加入铜粉,铜粉不溶解;再加入K NO3 固体,铜粉仍不溶解 |
| B、将等物质的量Cl2与SO2通入品红溶液,漂白性增强 |
| C、浓H2SO4与Cu或C反应都需加热,浓硝酸与Cu或C反应都不需加热 |
| D、铝、氧化铝、小苏打、醋酸铵都既能与盐酸又能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com