
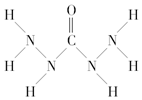
| A. | A中氧元素非金属性最强,故只有氧元素显负价 | |
| B. | 由A中的四种元素组成的化合物可能是离子化合物 | |
| C. | A分子中存在两类共价键 | |
| D. | A分子中氮原子没有孤电子对而氧原子有 |
分析 A、分子中除氧是负价,还有氮显负价;
B、碳氢氧氮四种元素可以形成铵盐;
C、分子中存极性共价键和非极性共价键;
D、分子除氧原子有孤电子对,还有每个氮原子都存在一对孤电子对;
解答 解:A、分子中除氧是负价,还有氮显负价,所以不只是氧元素显负价,故A错误;
B、碳氢氧氮四种元素可以形成铵盐,如碳酸铵或碳酸氢铵都是离子化合物,故B正确;
C、分子中存极性共价键和非极性共价键,如氮氮非极性键和氮氢等极性键,所以分子中存在两类共价键,故C正确;
D、分子除氧原子有孤电子对,还有每个氮原子都存在一对孤电子对,而不是只有氧原子存在,故D错误;
故选:BC.
点评 本题考查化学键的概念,为高频考点,把握结构和成键类型及相关概念为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:解答题
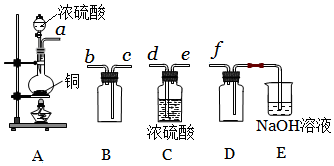
 已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在日常生活中,电化腐蚀是造成钢铁腐蚀的主要原因 | |
| B. | 明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 | |
| C. | SO2具有漂白性,可用于漂白纸浆,但不可以用于漂白食品 | |
| D. | 纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gH2O所含电子数为10NA | |
| B. | 常温常压下,48gO3和O2含氧原子数目3NA | |
| C. | 1molNa2O2所含阴离子数目为NA | |
| D. | 11.2L氢气中所含原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K 越大,反应物的转化率越小 | B. | K 与温度一定有关 | ||
| C. | K 与生成物的浓度一定有关 | D. | K 与反应物的浓度一定有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
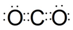 ;该化合物熔沸点低于CS2的原因是两者都为分子晶体,且结构相似,CS2式量大于CO2,CS2范德华力大,故CS2熔沸点高于CO2.
;该化合物熔沸点低于CS2的原因是两者都为分子晶体,且结构相似,CS2式量大于CO2,CS2范德华力大,故CS2熔沸点高于CO2.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 有12mol(NH4)2SO4分解 | B. | 有6mol原子被还原 | ||
| C. | 生成2mol氧化产物 | D. | 生成7molH2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com