
分析 设烷烃的化学式为CnH2n+2,根据燃烧方程式计算,燃烧方程式为:CnH2n+2+(n+$\frac{2n+2}{4}$)O2$\stackrel{点燃}{→}$nCO2+(n+1)H2O.
解答 解:设烷烃的化学式为CnH2n+2,
CnH2n+2+(n+$\frac{2n+2}{4}$)O2$\stackrel{点燃}{→}$nCO2+(n+1)H2O
1 (n+$\frac{2n+2}{4}$)
0.1 0.8
则有:n+$\frac{2n+2}{4}$=$\frac{0.8}{0.1}$=8,解得n=5,故烷烃化学式为:C5H12.结构简式有三种:CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、(CH3)2C(CH3)2.
答:烷烃分子式为CnH2n+2;结构简式为CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、(CH3)2C(CH3)2.
点评 本题考查有机物分子式的确定,为高频考点,侧重于学生的分析、计算能力的考查,题目难度不大,注意从有机物燃烧的化学方程式的角度解答该题.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
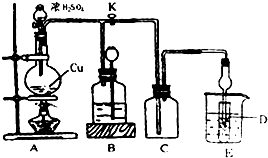
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn为正极 | B. | 负极反应式:O2+4H++4e-→2H2O | ||
| C. | 正极发生氧化反应 | D. | 电解液肯定不是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 客观事实 | 理论解释 |
| A | Na+比Na原子稳定 | Na+最外电子层有8个电子而Na只有1个 |
| B | 熔化状态下NaCl能导电而NaCl晶体不能导电 | 熔化状态下的NaCl中存在离子而NaCl晶体中没有离子 |
| C | 钾原子比钠原子更易失去电子 | 钾的核电荷数比钠的多 |
| D | 纯碱溶液能使湿润的紫色石蕊试纸变蓝色 | 纯碱能电离出OH-而使石蕊试纸变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
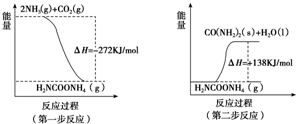
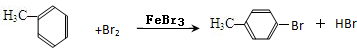 或
或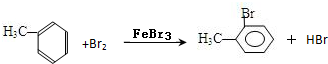
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴入KSCN溶液显红色的溶液中:K+、Fe2+、SO42-、Cl- | |
| B. | 1 mol•L-1的烧碱溶液中:S2-、SO32-、SO42-、K+ | |
| C. | 使淀粉碘化钾试纸变蓝的溶液:Cs+、Ba2+、S2-、Cl- | |
| D. | 含有大量HCO3-的澄清透明溶液中:K+、NH4+、SO42-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③② | B. | ②①③ | C. | ③②① | D. | ③①② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com