
 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 不慎打翻燃着的酒精灯,立即用湿抹布盖灭 | |
| B. | 浓碱液滴在皮肤上,立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 给盛有液体的试管加热时,要不断移动试管或加入碎瓷片 | |
| D. | 金属钠着火时,立即用泡沫灭火器进行灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
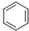 +CH3CH2CH2Cl$\stackrel{催化剂}{→}$
+CH3CH2CH2Cl$\stackrel{催化剂}{→}$ 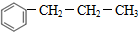 +HCl
+HCl
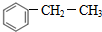 ,F的结构简式为
,F的结构简式为 ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ②③④ | C. | ①④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素(或元 素代码) | 铍 | A | B | C | D | E | F |
| 原子半径 (10-10m) | 0.89 | 1.60 | 1.43 | 0.75 | 0.74 | 1.02 | 0.99 |
| 最高价态 | +2 | +2 | +3 | +5 | - | +6 | +7 |
| 最低价态 | - | - | - | -3 | -2 | -2 | -1 |
 .
. .它与C元素最高价氧化物水化物反应的生成物是属于离子(离子或共价)化合物,其中含有的化学键类型有离子键、共价键.
.它与C元素最高价氧化物水化物反应的生成物是属于离子(离子或共价)化合物,其中含有的化学键类型有离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y | Z | M |
| A | H2S | S | SO3 | O2 |
| B | Mg | C | CO | CO2 |
| C | NaOH | Na2CO3 | NaHCO3 | CO2 |
| D | NH3 | NO | NO2 | O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥⑦⑩ | B. | ①④⑧⑩ | C. | ③⑤⑦⑨ | D. | ③⑥⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com