
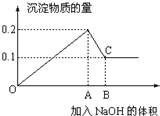
 在100mL MgCl2和AlCl3的混和溶液中,逐滴加入1mol/L NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如图所示,则:
在100mL MgCl2和AlCl3的混和溶液中,逐滴加入1mol/L NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如图所示,则:| n |
| V |
| 0.6mol |
| 1mol/L |
| n |
| V |
| 0.1mol |
| 0.1L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③④ | C、②③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、3:7 |
| C、7:3 | D、81:77 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 4 |
| A、K2O?Al2O3?4SiO2 |
| B、K2O?Al2O3?6SiO2 |
| C、K2O?Al2O3?8SiO2 |
| D、K2O?Al2O3?2SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色 |
| B、欲除去Cl2中少量HCl气体,可将此混合气体通过盛饱和食盐水的洗气瓶 |
| C、漂白粉有效成分是CaCl2和Ca(ClO)2,应密闭保存 |
| D、SO2和Cl2都具有漂白作用,所以将两种气体同时作用于潮湿有色物质,可大大增强漂白作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、赤铁矿的主要成分是Fe3O4 |
| B、铁与水蒸气在高温下的反应产物为Fe2O3和H2 |
| C、除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤 |
| D、常温下,将铁钉投入浓硝酸中可生成Fe(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加碘食盐能使淀粉溶液变蓝 |
| B、用电石和水反应制乙炔是氧化还原反应 |
| C、1mol乙酸与足量乙醇在浓硫酸催化下加热,可生成1 mol乙酸乙酯 |
| D、利用电石与水反应制取C2H2时,可采用CuSO4溶液除去杂质气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com