
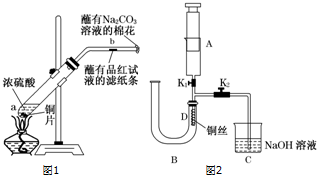
分析 实验一:(1)铜和浓硫酸在加热条件下能发生反应,生成硫酸铜和二氧化硫、水;铜的化合价升高2价失去两个电子,硫酸中硫的化合价降低2价得到两个电子,依据生成1mol二氧化硫转移2mol电子计算生成112mL气体(标准状况)转移的电子数;
(2)二氧化硫能使品红溶液褪色,但二氧化硫的漂白性不稳定,加热时会恢复原来的颜色;
实验二:(1)在A中吸入一定量的空气,然后关闭K1,打开止水夹 K2,使铜与稀硝酸反应生成的一氧化氮进入集气瓶;若U形管右端稀硝酸接触胶塞时,U形管中空气已被排净;
(2)稀硝酸与铜反应生成硝酸铜和NO和水,据此写出反应的离子方程式;
(3)NO为无色,用到空气后一氧化氮与氧气反应生成红棕色的二氧化氮,据此可检验NO.
解答 解:实验一:(1)浓硫酸具有强氧化性,能和铜反应,被铜还原为二氧化硫,所以产物有生成的硫酸铜、二氧化硫和水;书写化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,铜的化合价升高2价失去两个电子,硫酸中硫的化合价降低2价得到两个电子,生成1mol二氧化硫转移2mol电子,现放出112mL气体(标准状况),生成n(SO2)=$\frac{112×1{0}^{-3}L}{22.4L/mol}$=5×10-3mol,转移5×10-3mol×2=0.01mol电子,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;0.01 mol;
(2)二氧化硫能和有色物质生成无色物质,二氧化硫能使品红溶液褪色,所以二氧化硫具有漂白性;但生成的无色物质不稳定,加热时会恢复原来的颜色,滤纸变红,
故答案为:蘸有品红溶液的滤纸条褪色;滤纸变红;
实验二:(1)在A中吸入一定量的空气,然后关闭K1,打开止水夹K2,使铜与稀硝酸反应生成的一氧化氮进入集气瓶,当U形管右端稀硝酸接触胶塞时,可以确定U形管中空气已被赶尽,
故答案为:关闭;U形管右端稀硝酸接触胶塞;
(2)稀硝酸与铜反应生成硝酸铜和NO,反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(3)B中硝酸和铜反应生成NO,易与氧气反应,则将A中空气压入B中,会有红棕色气体生成,如果观察到红棕色,则说明生成NO而不是氢气,
故答案为:打开止水夹K1,把注射器中的空气压入U形管中,若观察到D处气体变红棕色,则证明收集的是NO,而不是H2.
点评 本题考查性质方案的设计,涉及铜和浓硫酸、浓硝酸的反应、SO2、NO性质的检验以及尾气处理,该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生实验能力的培养和解题方法的指导,有助于培养学生规范、严谨的实验设计和评价能力.


科目:高中化学 来源: 题型:选择题
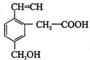 某机物的结构如图所示,这种有机物不可能具有的性质是( )
某机物的结构如图所示,这种有机物不可能具有的性质是( )| A. | ①④ | B. | ②⑤ | C. | ②⑥ | D. | 只有⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
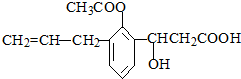
| A. | 该物质共有两种含氧官能团 | |
| B. | 该物质属于芳香烃 | |
| C. | 1 mol该有机物能与3mol的NaOH反应 | |
| D. | 1 mol该有机物在一定条件下可以消耗6molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法不正确的是( )
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法不正确的是( )| A. | H2O的分解反应是吸热反应 | |
| B. | 过程①是太阳能转换成化学能 | |
| C. | 过程②是化学能转换为电能 | |
| D. | 氢气不易贮存和运输,无开发利用价值 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
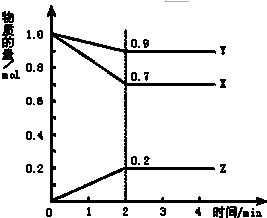 某温度时,在2L容器中X、Y、Z三种物质随时间的变化曲线如图所示,由图中的数据分析,反应开始至2min时:
某温度时,在2L容器中X、Y、Z三种物质随时间的变化曲线如图所示,由图中的数据分析,反应开始至2min时:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HCl>H2S>PH3 | B. | 酸性强弱:H4SiO4<H2CO3<HNO3 | ||
| C. | 金属性:Na<Mg<Al | D. | 沸点:H2O>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列说法是正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列说法是正确的是( )| A. | 洗气瓶中产生的沉淀是碳酸钡 | |
| B. | 从Z导管出来的气体中无二氧化碳 | |
| C. | 洗气瓶中产生的沉淀是碳酸钡和硫酸钡的混合物 | |
| D. | 在导管中有红棕色气体出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物可能含共价键,共价化合物中可能含离子键 | |
| B. | 碘易升华是因为分子间的共价键较弱 | |
| C. | 构成单质分子的微粒一定含有化学键 | |
| D. | 在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 依原电池的原理设计出化学电源 | |
| B. | 原电池是化学电源的雏形 | |
| C. | 原电池输出电能的能力取决于组成原电池的负极材料的活泼性 | |
| D. | 氧化还原反应所释放出的化学能是化学电池的能量来源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com