
【题目】硝酸是一种重要的化工原料,用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取含硝基的炸药等。试回答下列问题:
(1)某同学对铁与稀硝酸的反应进行探究,若HNO3只被还原成NO,则:
①写出铁与过量稀硝酸反应的离子方程式:__。
②写出过量铁与稀硝酸反应的离子方程式:__。
③若28g铁与含1.6mol硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比为__。上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为__g。
(2)饮用水中NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:__Al+__NO3-+__OH-+__=__[Al(OH)4]-+__N2↑。
②上述反应中,还原剂与还原产物的物质的量之比是__,反应中转移电子0.3mol,生成__mL(标准状况下)N2。
【答案】Fe+NO3-+4H+=Fe3++NO↑+2H2O 3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O 2∶3 40 10 6 4 18H2O 10 3 10∶3 672
【解析】
(1)①铁与过量稀硝酸反应生成硝酸铁、NO和水,离子方程式为Fe+NO3-+4H+=Fe3++NO↑+2H2O;
②过量铁与稀硝酸反应生成硝酸亚铁、NO和水,离子方程式为3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O;
③28g铁的物质的量为0.5mol,与含1.6mol硝酸的稀硝酸恰好完全反应,设生成的Fe3+和Fe2+的物质的量分别是xmol、ymol,即生成xmol硝酸铁和ymol硝酸亚铁,根据N原子守恒知,生成NO的物质的量为(1.6-3x-2y)mol,根据得失电子守恒有3x+2y=3(1.6-3x-2y),又有x+y=0.5,解得x=0.2,y=0.3,则生成的Fe3+和Fe2+的物质的量之比为2∶3;上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,由于生成的氢氧化亚铁在空气中易被氧化为氢氧化铁,氢氧化铁受热分解最终得到的固体是氧化铁,故其物质的量为0.5mol×![]() =0.25mol,质量为40g;
=0.25mol,质量为40g;
(2)①根据得失电子守恒、原子守恒及电荷守恒,可知离子方程式为10Al+6NO3-+4OH-+18H2O=10[Al(OH)4]-+3N2↑;
②上述反应中,还原剂是Al,还原产物是N2,其物质的量之比为10∶3;由方程式可知,生成3molN2时转移电子30mol,所以反应中转移电子0.3mol,生成N2的体积(标准状况下)为![]() ×22.4L·mol-1=0.672L=672mL。
×22.4L·mol-1=0.672L=672mL。
【点睛】
金属与硝酸反应的计算一般常采用以下方法:①原子守恒法:HNO3与金属反应时,一部分HNO3起酸的作用,以NO的形式存在于溶液中;一部分作为氧化剂转化为还原产物,这两部分中氮原子的总物质的量等于反应消耗的HNO3中氮原子的物质的量;②得失电子守恒法:HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得到电子的物质的量等于金属失电子的物质的量;③电荷守恒法:HNO3过量时反应后溶液中(不考虑OH-)有:c(NO3-)=c(H+)+nc(Mn+)(Mn+代表金属离子);④离子方程式计算法:金属与H2SO4、HNO3的混合酸反应时,由于溶液中NO3-在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先作过量判断,然后根据完全反应的金属或H+或NO3-进行相关计算,且溶液中要符合电荷守恒。
【题型】综合题
【结束】
21
【题目】如图是氮元素的几种价态与物质类别的对应关系。请回答下列问题:

(1)写出N2的一种用途:___。
(2)HNO3与图中的物质C
(3)实验室制取物质B的化学方程式为____。
(4)NO2与水反应生成物质A的化学方程式为____。
(5)浓硝酸与木炭在加热条件下反应的化学方程式为___。
【答案】做保护气(或做冷冻剂、制氨气等) AgNO3 Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O 3NO2+H2O===2HNO3+NO 4HNO3(浓)+C
CaCl2+2NH3↑+2H2O 3NO2+H2O===2HNO3+NO 4HNO3(浓)+C![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
【解析】
(1)由于氮气的化学性质不活泼,所以可做保护气,也可做冷冻剂、制氨气等;
(2)检验Cl-的方法是先向待测液中加入硝酸酸化,再滴加AgNO3溶液,若产生白色沉淀,则证明待测液中含有Cl-,因此C为AgNO3;
(3)B是NH3,在实验室中用铵盐与碱共热来制取NH3,化学方程式为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(4)A是NO,NO2与水反应生成NO的化学方程式为3NO2+H2O=2HNO3+NO;
(5)浓硝酸有强氧化性,与木炭在加热条件下发生反应生成CO2、NO2和H2O,反应的化学方程式为4HNO3(浓)+C![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在下列反应中,反应物中每个原子都参加氧化还原反应的是( )
A.2KNO3+3C+S![]() K2S+N2↑+3CO2↑
K2S+N2↑+3CO2↑
B.2NaCl![]() 2Na+Cl2↑
2Na+Cl2↑
C.2AgNO3![]() 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在古代,我国人民就积累了不少对化学物质变化的认识。例如,晋代炼丹家、医学家葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银,积变又还成丹砂”。这句话中的丹砂指的是HgS,下列有关说法正确的是( )
A.这个过程只涉及物理变化
B.“积变又还成丹砂”过程中发生反应:HgS![]() Hg+S
Hg+S
C.实验室中不慎洒落的水银不能用硫黄处理
D.“丹砂烧之成水银”过程中还可能产生SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室测定铬铁矿中铬(Cr)含量的步骤如下:
步骤1:准确称取0.2000g铬铁矿试样放入锥形瓶中,加入适量磷酸和硫酸的混合酸,加热使试样完全溶解,冷却。
步骤2:向上述溶液中滴加5滴1%MnSO4溶液,再加入一定量的(NH4)2S2O8溶液,摇匀至溶液呈紫红色[先后发生Cr3+![]() Cr2O72-、Mn2+
Cr2O72-、Mn2+![]() MnO4-]。
MnO4-]。
步骤3:上述溶液加热煮沸至紫红色褪去[除去过量的(NH4)2S2O8和生成的MnO4-],冷却。
步骤4:用0.2000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定上述溶液至终点(发生Cr2O72-![]() Cr3+),消耗19.50mL标准溶液。
Cr3+),消耗19.50mL标准溶液。
(1)(NH4)2S2O8中阴离子的结构如图所示。从结构分析,(NH4)2S2O8置于棕色试剂瓶并于阴凉处保存的原因是__。
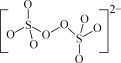
(2)“步骤2”中加入5滴1%MnSO4溶液的目的是__。
(3)“步骤3”中,如果继续加热煮沸时间不充足,会使铬含量的测定结果___(填“偏大”“不变”或“偏小”)。
(4)计算铬铁矿中铬的质量分数___(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从八角茴香中提取的莽草酸,是合成治疗禽流感的药物——达菲( Tamiflu) 的原料之一。其结构简式如图,下列有关莽草酸分子的说法正确的是
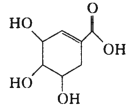
A.含有两种不同的官能团
B.7个碳原子共面
C.1mol能与4molNaOH 完全反应
D.既能使 Br2的CCl4溶液褪色 ,又能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取复合氧化钴的流程如下:
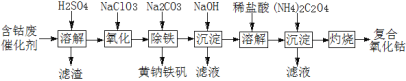
(1)用H2SO4溶解后过滤,得到的滤渣是____(填化学式)。将滤渣洗涤2~3次,再将洗液与滤液合并的目的是____。
(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,反应的离子方程式是____。
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3 =Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4 =Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是____。(仅供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(4)向氧化后的溶液中加入适量的Na2CO3调节酸度,使之生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的离子方程式:____。
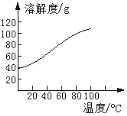
(5)已知CoCl2的溶解度曲线如图所示。向碱式碳酸钴沉淀中加入足量稀盐酸边加热边搅拌至完全溶解后,需趁热过滤的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用 0.1molL-1NaOH溶液滴定 20 mL 0.1 molL-1 某二元弱酸 H2A ( Ka1 =1.1×10-3,Ka2= 3.9×10-6 )溶液,滴定过程中溶液的 pH 变化曲线如图所示。下列说法正确的是
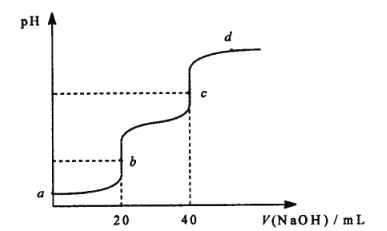
A.a 点的pH 大于2
B.b 点溶液中c(H2A) > c(A2-)
C.c 点溶液中c( HA-) + 2c(H2A ) = c( OH- )-c(H+)
D.d 点溶液中c (Na+) +c(H+) =c(A2-) +c(HA-) +c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式,书写正确的是( )
A.盐酸与石灰石反应:CO32ˉ+2H+ = CO2↑+H2O
B.铁与稀盐酸反应:2Fe+6H+ = 2Fe3++3H2↑
C.氢氧化铁胶体的制备:FeCl3 + 3H2O = Fe(OH)3+3HCl
D.硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42ˉ = BaSO4↓+Cu(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com