
设NA为阿伏加德罗常数的值,下列说法正确的是
A.4gNaOH固体所含电子总数为2NA
B.22.4LC2H6所含化学键总数为7 NA
C.常温常压下,14gCO、N2混合气体所含分子总数为NA
D.0.1 mol-1LNH4C1溶液中,NH4+与Cl一数之和小于0.2 NA
科目:高中化学 来源:2014-2015学年江苏省南通、扬州、连云港高三第二次调研测试化学试卷(解析版) 题型:填空题
【选做题】(12分)本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
X、Y、Z、M为前四周期中除氢以外原子序数依次增大的四种元素,X基态原子未成对电子数在所处周期中最多;Y元素原子核外共有3个能级,且最高能级电子数是前两个能级电子数之和;Z的单质常温下为淡黄色固体,ZY3分子呈平面正三角形;M原子外围电子排布式为3dn4sn。
请回答下列问题:
(1)X、Y、Z三种元素原子第一电离能由大到小的顺序是 。(用元素符号表示)
(2)某X氢化物分子结构式为:H-X=X-H,该分子中X原子的杂化方式是 ;Y元素简单氢化物的沸点高于Z的氢化物,主要原因是 。
(3)根据等电子原理,写出X2Y分子的电子式: 。
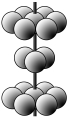
(4)M晶体的原子堆积方式为六方堆积(如图所示),则晶体中M原子配位数是 。某M配合物化学式是[M(H2O)5Cl]Cl2·H2O,1 mol该配合物中含配位键的数目是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三四月调研考试理综化学试卷(解析版) 题型:选择题
有一种基于乙醇酸性燃料电池原理设计的酒精检测仪,其原理是通过将乙醇氧化为乙酸来测定血液中乙醇的含量。下列有关说法正确的是
A.电池工作时消耗5.6 L O2,转移电子为1 mol
B.检测时,电解质溶液中的H+向负极移动
C.正极上发生的反应为:O2+4e-+2H2O=4OH-
D.负极上发生的反应为:CH3CH2OH-4e-+H2O=CH3COOH+4H+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
分子式为C8H8的两种同分异构体X和Y。X是一种芳香烃,分子中只有一个环;Y俗称立方烷,其核磁共振氢谱显示只有一个吸收峰。下列有关说法错误的是
A.X、Y均能燃烧,都有大量浓烟产生
B.X既能使酸性高锰酸钾溶液褪色,也能使溴水褪色,还能发生加聚反应
C.Y属于不饱和烃
D.Y的二氯代物有三种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省毕业生复习统一检测理综化学试卷(解析版) 题型:简答题
(14分)BaS是一种白色晶体,微溶于水,可用于制备立德粉、Na2S等。工业上可用H2与重晶石(BaSO4)在高温下反应制备BaS,热化学方程式为BaSO4(s)+4H2(g) BaS(s)+4H2O(g)
BaS(s)+4H2O(g)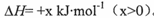 。回答下列问题:
。回答下列问题:
(1)在温度和容积不变的条件下,能说明该反应己达到平衡状态的是 (填字母序号)。
a.n(H2)=n(H2O)
b.容器内压强保持不变
c.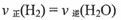
d.水蒸气的浓度保持不变
(2)平衡后下列措施既可提高反应速率,又可提高H2的转化率的是 (填字母序号)。
a.使用催化剂
b.升高反应体系的温度
c.增大反应容器的体积
d.及时从反应体系中分离出水蒸气
(3)将温度恒定为T℃,向体积为2L的密闭容器中加入一定量的重晶石和H2。在不同时间测得H2的物质的量如下表:

①2t时,n 1.20(填“>”、“<”或“=”)
②若氢气的平衡转化率为a,则该温度下反应的化学平衡常数K= (用含a的
代数式表示);若测得该反应达到平衡时吸热Q kJ ,则x= (用含a、Q的代数式表示)。
(4)为了探究温度、固体反应物的表面积对化学反应速率的影响,某同学在一固定容积的密闭容器中加入一定量的重晶石和H2,设计了下表中的三组实验:
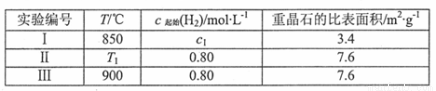
①填写上表中的实验条件:
②在直角坐标系中画出I, II两组实验氢气的浓度随时间变化趋势图,并在每条曲线上标明对应的实验编号。
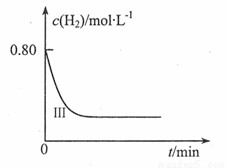
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市七校高三4月联考化学试卷(解析版) 题型:简答题
(共15分)不饱和酯类化合物在药物、涂料等领域应用广泛。
(1)下列关于化合物I的说法,正确的是
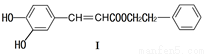
A.可能发生酯化反应和银镜反应
B.1mol化合物I最多与2molNaOH反应
C.与FeCl3溶液能显紫色
D.能与溴发生取代和加成反应
(2)下面反应是一种由烯烃直接制备不饱和酯的新方法
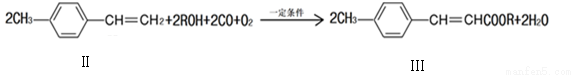
①化合物II的分子式为 。
②1mol化合物II能与 molH2恰好反应生成饱和烃类化合物。
③化合物Ⅲ与足量的NaOH溶液共热的化学方程式为 ;反应类型:
(3)3﹣对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下:
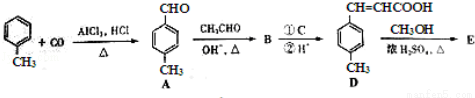
已知:HCHO+CH3CHO CH2=CHCHO+H2O
CH2=CHCHO+H2O
①A中官能团的名称为 。D中含氧官能团的名称为 。
②E的结构简式为 。
③试剂C可选用下列中的
a、溴水 b、银氨溶液
c、酸性KMnO4溶液 d、新制Cu(OH)2悬浊液
④B在一定条件下可以生成高聚物F,该反应的化学方程式为 _________ 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河西区高三下学期总复习质量调查(二)化学试卷(解析版) 题型:简答题
(14分)氮及其化合物在工农业生产、生活中有重要作用。请按要求回答下列相关问题:
(1)食品添加剂铵明矾NH4Al(SO4)2·12H2O高温可分解,下列关于其分解产物的预测不合理的是_____。
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O
(2)汽车发动机工作时也会引发N2和O2反应产生大气污染物NO,其能量变化示意图为_____
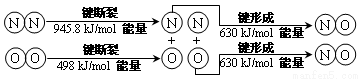
则该反应的热化学方程式为_________________________。
(3)工业合成氨的反应:N2(g)+3H2(g) 2NH3(g) △H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
2NH3(g) △H<0,分别在T1、T2温度下,改变起始氢气物质的量,测得平衡时氨的体积分数如图所示:
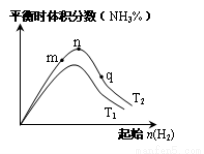
①比较在m、n、q三点所处的平衡状态中,反应物N2的转化率最高的是________点。
②T2条件下,在2 L的密闭容器中,充入x mol N2和y mol H2时,3 min达平衡,此时反应物的转化率均为a,写出下列仅含a、x的表达式(不必化简):v(N2)=_______;该反应的平衡常数的值K =_______。
③图像中T2________T1(填“高于”、“低于”、“等于”或“无法确定”)。
④科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,这提高了氮气和氢气的转化率。写出电化学合成过程中发生还原反应的电极方程式:___________________________________。
(4)将质量相等的四份铁粉和铜粉的均匀混合物,分别加入同浓度稀硝酸充分反应,(假设硝酸的还原产物只有NO)实验数据如下表:
编 号 | ① | ② | ③ | ④ |
稀硝酸体积/mL | 100 mL | 200 mL | 300 mL | 400 mL |
剩余金属/g | 18.0 g | 9.6 g | 0 | 0 |
NO体积/L(标准状况下) | 2.24 L | 4.48 L | 6.72 L | V |
下列有关分析推断正确的是____________。
A.硝酸起始浓度为4 mol/L B.①中溶解了5.6 g Fe
C.③中n(Cu2+) = 0.15 mol D.④中V = 6.72 L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列应用不涉及氧化还原反应的是
A.Na2O2用作呼吸面具的供氧剂
B.工业上电解熔融状态的Al2O3制备Al
C.工业上利用合成氨实现人工固氮
D.实验室用NH4Cl和Ca(OH)2制备NH3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闵行区高三下学期质量调研考试(二模)化学试卷(解析版) 题型:填空题
(本题共12分)含硫化合物在生产、生活中有广泛应用,其吸收和处理也十分重要。回答下列问题:
1.SO2具有还原性,写出将SO2气体通入 FeCl3溶液中的离子方程式,并标出电子转移的数目及方向。______________________________________________________________________
2.在Na2SO3溶液中滴加酚酞,溶液变红色,若在该溶液中滴入过量的BaCl2溶液,现象是_________,请结合离子方程式,运用平衡原理进行解释_____________________。
3.等体积等物质的量浓度的 NaClO溶液与Na2SO3溶液混合后,溶液显______性。此时溶液中浓度相等的微粒是___________________________________________。
4.已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15 H2CO3:Ki1=4.3×10-7 Ki2=5.6×10-11
含H2S尾气用足量的Na2CO3溶液来吸收。写出离子反应方程式。____________
常温时,等体积等浓度的Na2S和Na2CO3溶液的离子总数:N前___N后(填“>”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com