
下列有关NaClO和NaCl混合溶液的叙述正确的是 ( )
A.该溶液中,H+、NH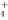 、SO
、SO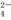 、I-可以大量共存
、I-可以大量共存
B.该溶液中,Ag+、K+、NO 、NH
、NH 可以大量共存
可以大量共存
C.该溶液中, Fe2+、Fe3+、Cl-、NO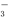 可以大量共存
可以大量共存
D.向该溶液中加入浓盐酸,每产生1 molCl2,转移电子约为6.02×1023个
科目:高中化学 来源:2016-2017学年吉林省长春市五县高二上期末化学试卷(解析版) 题型:选择题
一定条件下,在密闭容器中充入一定量的X和Y发生可逆反应:X(g)+2Y(g)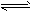 3Z(g),达到平衡,测得Y的转化率为 37.5%,X的转化率为25%,则反应开始时,充入容器中的X和Y的物质的量之比为( )
3Z(g),达到平衡,测得Y的转化率为 37.5%,X的转化率为25%,则反应开始时,充入容器中的X和Y的物质的量之比为( )
A.1∶3 B.3∶1 C.4∶3 D.3∶4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高二上期中化学试卷(解析版) 题型:填空题
在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
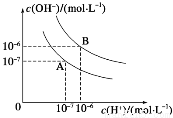
(1)A曲线温度比B曲线温度___________。(填“高”或“低”)
(2)曲线A对应的温度下,pH=9的NaClO溶液与pH=5的盐酸中溶液水电离出的CH+之比为______________
(3)曲线B对应的温度下,pH=9的NaOH溶液与pH=4的H2 SO4 溶液混合,若所得混合溶液的pH=6,则NaOH溶液与H2SO4溶液的体积比为______________
SO4 溶液混合,若所得混合溶液的pH=6,则NaOH溶液与H2SO4溶液的体积比为______________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高二上期中化学试卷(解析版) 题型:选择题
酸碱恰好完全中和时,它们一定相等的是 
A.质量 B.物质的量 C.物质的量浓度 D.H+和OH-的物质的量
查看答案和解析>>
科目:高中化学 来源:2017届广东省惠州市高三上第三次调研化学试卷(解析版) 题型:填空题
[物质结构与性质]氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)溴的价电子排布式为 ;PCl3的空间构型为 。
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列 式发生:
A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(3)根据下表第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是__________
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ•mol﹣1) | 1681 | 1251 | 1140 | 1008 |
(4)下列分子既不存在s﹣pσ键,也不存在p﹣pπ键的是
A. HCl B.HF C. SO2 D. SCl2
(5)已知COCl2为平面形,则COCl2中心碳原子的杂化轨道类型为 ,写出CO的等电子体的微粒 (写出1个)。
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由此可判断该钙的氧化物的化学 式为 。已知该氧化物的密度是ρg•cm﹣3,则晶胞离得最近的两个钙离子间的距离为 cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
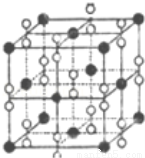
查看答案和解析>>
科目:高中化学 来源:2017届广东省惠州市高三上第三次调研化学试卷(解析版) 题型:选择题
莽草酸是合成达菲的主要原料,其结构简式如图,下列说法正确的是:( )

A. 分子式为C7H8O5 B.能使溴的四氯化碳溶液褪色
C.只能发生加成反应和取代反应 D.分子中含有2种官能团
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上第二次段考化学试卷(解析版) 题型:选择题
根据图,下列判断中正确的是( )
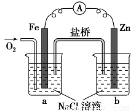
A.电流由Zn经外电路流向Fe
B.烧杯b中发生氧化反应
C.烧杯a中发生的反应为:2H++2e-===H2↑
D.盐桥中的阴离子向烧杯a移动
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省定西市通渭县高三上学期期末化学试卷(解析版) 题型:选择题
化学与生活、社会发展息息相关,下列有关说法与氧化还原反应无关的是( )
A.KNO3、KClO3与单质S、C2H5OH不能混搭存放在同一库房间
B.缺铁性补血服用补铁剂时,需与维C同时服用
C.铜制品、铁制品 在潮湿的空气中生锈
在潮湿的空气中生锈
D.用乙醚从黄花蒿中提取青蒿素
查看答案和解析>>
科目:高中化学 来源:2017届广东省肇庆市高三上学期二模化学试卷(解析版) 题型:实验题
砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
(l)冶炼废水中砷元素主要以亚砷酸(H3 AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
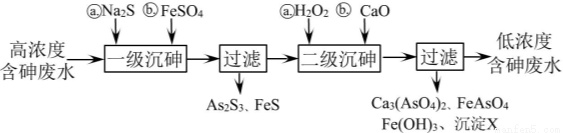
已知:I .As2 S3与过量的S2一存在以下反应:As2S3(s)+3S2—(aq) 2AsS33—(aq);
2AsS33—(aq);
II.亚砷酸盐的溶解性大于相应砷酸盐。
①亚砷酸中砷元素的化合价为 ;
②砷酸的第一步电离方程式为 ;
③“一级沉砷”中FeSO4的作用是 ;
④“二级沉砷”中H2O2与含砷物质反应的化学方程式为 ;
⑤沉淀X为 (填化学式)。
(2)冶炼废渣中的砷元素主要以As2O3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10 -6g)。
步骤1:取10 g废渣样品,粉碎后与锌粉混合,加人H2 SO4共热,生成H3As气体。
步骤2:将H3As气体通人AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
①AsH3的电子式为 ;
②步骤2的离子方程式为 ;
③固体废弃物的排放标准中,砷元素不得高于4.0×10一5g·kg一1,请通过计算说明该排放的废渣中砷元素的含量 (填“符合”、“不符合”)排放标准,原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com