
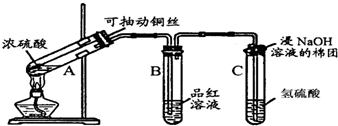
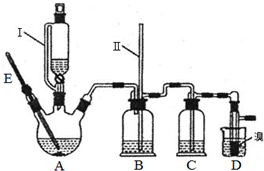
 某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验:
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验:分析 (1)装置A中为铜跟浓硫酸的反应,产物为硫酸铜,二氧化硫和水;
(2)试管A中气体压强减小,空气从D导管进入试管A中;
(3)A中本有水生成,浓硫酸与Cu反应有黑色沉淀干扰观察.
解答 解(1)装置A中是铜与浓硫酸的反应,Cu+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O 故答案为:Cu+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;(2)熄灭酒精灯后,反应慢慢停止,试管A中气体压强减小,因为有导管D的存在,空气从D导管进入试管A中,B中的液体不会倒吸.故答案为:试管A中气体压强减小,空气从D导管进入试管A中;(3)A中反应有水生成,铜与浓硫酸反应会生成氧化铜,黑色氧化铜影响对试管内溶液颜色的观察,若加入水,浓硫酸变稀,氧化铜与稀硫酸反应会生成硫酸铜,不能确认原反应硫酸铜的生成,D不合理.故答案为:D.
点评 本题考查了铜与浓硫酸的实验,考生要掌握实验原理,实验装置的选择及原因.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、NO3-、MnO4- | B. | K+、Na+、Cl-、SO42- | ||
| C. | K+、Na+、Br-、Cu2+ | D. | Na+、Ba2+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
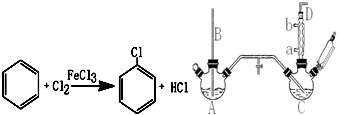
| 名称 | 相对分子质量 | 沸点/(℃) | 密度/(g/mL) |
| 苯 | 78 | 78 | 0.88 |
| 氯苯 | 112.5 | 132.2 | 1.1 |
| 邻二氯苯 | 147 | 180.4 | 1.3 |

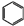 +2HCl+O2$→_{210℃}^{催化剂}$2
+2HCl+O2$→_{210℃}^{催化剂}$2 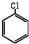 +2 H2O.
+2 H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
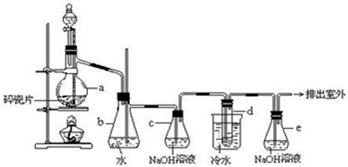
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知:乙醇、1,2-二溴乙烷、乙醚的有关物理性质如下表所示
已知:乙醇、1,2-二溴乙烷、乙醚的有关物理性质如下表所示| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 通常状况下的状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 熔点/℃ | -130 | 9 | -116 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
| A. | 蒸馏 | B. | 分液 | C. | 过滤 | D. | 蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com