
分析 (1)Al与NaOH溶液反应,而Fe不能;
(2)Fe与氯化铁反应生成氯化亚铁,且Fe不能溶于水;
(3)FeCl2与氯气反应生成FeCl3;
(4)Al2O3与NaOH反应,而Fe2O3不能.
解答 解:(1)Al与NaOH溶液反应,而Fe不能,选NaOH溶液来除杂,发生离子反应为2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(2)Fe与氯化铁反应生成氯化亚铁,且Fe不能溶于水,选Fe来除杂,发生的离子反应为Fe+2Fe3+═3Fe2+,故答案为:Fe+2Fe3+═3Fe2+;
(3)FeCl2与氯气反应生成FeCl3,则选择氯气来除杂,发生的离子反应为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)Al2O3与NaOH反应,而Fe2O3不能,则选NaOH溶液来除杂,发生离子反应为Al2O3+2OH-═2AlO2-+H2O,故答案为:Al2O3+2OH-═2AlO2-+H2O.
点评 本题考查混合物的分离提纯,为高频考点,把握物质的性质、发生的反应等为解答的关键,侧重分析与应用能力的考查,注意离子反应的书写,题目难度不大.


科目:高中化学 来源: 题型:实验题
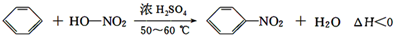
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
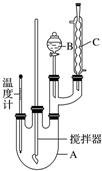
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、I-、CO32-、ClO- | B. | Ba2+、Na+、SCN-、Cl- | ||
| C. | Fe2+、H+、K+、NO3- | D. | Cu2+、Mg2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
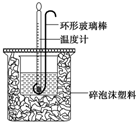 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和右图所示装置进行测定中和热的实验,得到表中的数据
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和右图所示装置进行测定中和热的实验,得到表中的数据| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃[来源:Z,xx,k.Com] | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.3 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 20.5 | 20.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
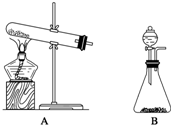 氨气是化学实验室常需制取的气体.实验室制取氨气通常有两种方法:
氨气是化学实验室常需制取的气体.实验室制取氨气通常有两种方法:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
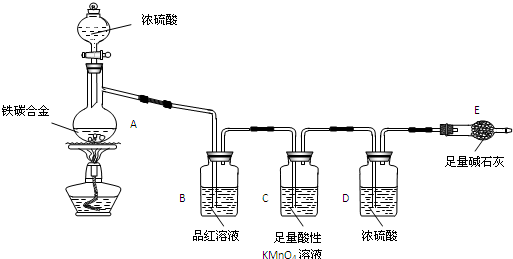
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L 的Na2CO3溶液中,含有的Na+离子数为2 NA | |
| B. | 0.5 mol H2SO4含有的原子数目为3.5NA | |
| C. | 32 g O2所含的分子数目为NA | |
| D. | 27g金属铝变成铝离子时失去的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
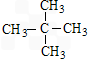 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com