
分析 (1)依据热化学方程式和盖斯定律计算得到所需让化学方程式;
(2)先将MgCl2•6H20转化为MgCl2•NH4Cl•nNH3,然后在700℃脱氨得到无水氯化镁,依据原子守恒书写化学方程式;用惰性电极电解熔融氯化镁,阴极上是镁离子得到电子生成镁;
(3)氧化还原反应电子转移守恒计算.
解答 解:(1)①Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ•mol-1
②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=-64.4kJ•mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
由盖斯定律②-2×①得到Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3=-64.4KJ/mol-2×(-74.5KJ/mol)=+84.6kJ/mol,则△H3=+84.6kJ/mol,
故答案为:+84.6;
(2)MgCl2•NH4Cl•nNH3,在700℃脱氨得到无水氯化镁,反应的化学方程式:MgCl2•NH4Cl•nNH3$\frac{\underline{\;700℃\;}}{\;}$MgCl2+(n+1)NH3↑+HCl↑;用惰性电极电解熔融氯化镁,阴极上是镁离子得到电子生成镁,电极反应为:Mg2++2e-=Mg;
故答案为:MgCl2•NH4Cl•nNH3$\frac{\underline{\;700℃\;}}{\;}$MgCl2+(n+1)NH3↑+HCl↑;Mg2++2e-=Mg;
(3)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,反应中生成2molAl转移电子6mol,每生成27gAl转移电子的物质的量为3mol,
故答案为:3mol.
点评 本题考查了金属单质及其化合物的综合应用、热化学方程式的书写等知识,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用所学知识的能力,注意掌握盖斯定律的概念及应用方法.


科目:高中化学 来源: 题型:选择题
| 方案 | 操作 | 判断 |
| A | 分别加入澄清石灰水 | 产生沉淀者为Na2CO3 |
| B | 分别加入等浓度的稀盐酸 | 反应较剧烈者为Na2CO3 |
| C | 分别加入CaCl2溶液 | 产生沉淀者为Na2CO3 |
| D | 逐渐加入等浓度的盐酸 | 立即产生气泡者为Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
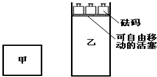 一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g)△H<0.现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图).关于两容器中反应的说法正确的是( )
一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g)△H<0.现将2 mol A和2 mol B充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图).关于两容器中反应的说法正确的是( )| A. | 两容器达平衡后升高相同的温度时,甲容器的反应速率大于乙容器的速率 | |
| B. | 两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的密度不同 | |
| C. | 甲容器中的反应先达到化学平衡状态 | |
| D. | 在甲容器中再充入2 mol A和2 mol B,平衡后甲中物质C的物质的量是乙中物质C的物质的量的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
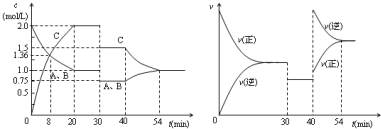
| A. | 30min时降低温度,40min时升高温度 | |
| B. | 8min前A的平均反应速率为0.17mol/(L•min) | |
| C. | 反应方程式中的x=1,正反应为放热反应 | |
| D. | 20min~40min间该反应的平衡常数均为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 至少存在5种离子 | |
| B. | Cl-一定存在,且c(Cl-)≥0.2mol/L | |
| C. | SO42-、NH4+、Fe3+一定存在,Al3+、K+、Cl-可能存在 | |
| D. | CO32-一定不存在,SO42-、NH4+、Fe3+、Cl-一定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com