
【题目】一定温度下,在3个容积均为1.0L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。下列说法正确的是
PCl3(g)+Cl2(g)。下列说法正确的是
容器 编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(PCl5) | c(PCl3) | c(Cl2) | c(Cl2) | |
Ⅰ | 0.4 | 0 | 0 | 0.2 |
Ⅱ | 1.05 | 0.05 | 1.95 | |
Ⅲ | 0.8 | 0 | 0 | |
A.达平衡时,容器Ⅰ中![]() 比容器Ⅱ中的大
比容器Ⅱ中的大
B.达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为6∶31
C.达平衡时,容器Ⅲ中Cl2的体积分数大于![]()
D.达平衡时,容器Ⅲ中0.4mol·L-1<c(PCl5)<0.8mol·L-1
【答案】BD
【解析】
A.容器编号Ⅰ PCl5(g)PCl3(g)+Cl2(g)。
起始物质的量浓度(molL﹣1) 0.4 0 0
转化物质的量浓度(molL﹣1) 0.2 0.2 0.2
平衡物质的量浓度(molL﹣1) 0.2 0.2 0.2
此时![]() =1,K=
=1,K=![]() =
=![]() =0.2,容器Ⅱ,开始时
=0.2,容器Ⅱ,开始时![]() ≈1.86,此时Qc=
≈1.86,此时Qc=![]() ≈0.09<K,说明容器Ⅱ中反应向正反应方向移动,c(Cl2)浓度增大,c(PCl5)减小,达到平衡时
≈0.09<K,说明容器Ⅱ中反应向正反应方向移动,c(Cl2)浓度增大,c(PCl5)减小,达到平衡时![]() >1.86>1,则达平衡时,容器Ⅰ中c(Cl2)/c(PCl5) 比容器Ⅱ中的小,故A错误;
>1.86>1,则达平衡时,容器Ⅰ中c(Cl2)/c(PCl5) 比容器Ⅱ中的小,故A错误;
B.假设容器Ⅰ与容器Ⅱ中的总压强之比为 6:31,压强之比等于物质的量浓度之比,容器Ⅰ总物质的量浓度为0.2molL﹣1×3=0.6molL﹣1,说明容器Ⅱ总物质的量浓度为3.1molL﹣1,根据A得出容器Ⅱ反应向正反应方向移动,列化学平衡三段式
容器Ⅱ PCl5(g)PCl3(g)+Cl2(g)
起始物质的量浓度(molL﹣1) 1.05 0.05 1.95
转化物质的量浓度(molL﹣1) x x x
平衡物质的量浓度(molL﹣1) 1.05﹣x 0.05+x 1.95+x
容器Ⅱ总物质的量浓度为3.1molL﹣1,则3.1=1.05﹣x+0.05+x+1.95+x,解得x=0.05;
则平衡时c(PCl5)=1molL﹣1,c(PCl3)=0.1molL﹣1,c(Cl2)=2molL﹣1,此时Qc=![]() =0.2=K,说明此时达到化学平衡状态,假设成立,故B正确;
=0.2=K,说明此时达到化学平衡状态,假设成立,故B正确;
C.容器Ⅰ达平衡时,Cl2的体积分数为![]() =
=![]() ,容器容积为2L,起始c(PCl5)为0.8molL﹣1与容器Ⅰ为1L,起始c(PCl5)为0.4molL﹣1,是等效平衡;容器Ⅲ是1L,相当于增大压强,平衡向逆反应方向移动,Cl2的量减小,所以达平衡时,容器Ⅲ中Cl2的体积分数小于1/3,故C错误;
,容器容积为2L,起始c(PCl5)为0.8molL﹣1与容器Ⅰ为1L,起始c(PCl5)为0.4molL﹣1,是等效平衡;容器Ⅲ是1L,相当于增大压强,平衡向逆反应方向移动,Cl2的量减小,所以达平衡时,容器Ⅲ中Cl2的体积分数小于1/3,故C错误;
D.容器容积为2L,起始c(PCl5)为0.8molL﹣1与容器Ⅰ为1L,起始c(PCl5)为0.4molL﹣1,是等效平衡,容器Ⅲ是1L,若此时平衡不移动,则c(PCl5)=0.4 molL﹣1,但容积体积变为1L,相当于增大压强,平衡平衡向逆反应方向移动,c(PCl5)增大,所以c(PCl5)>0.4 molL﹣1,又因反应开始,消耗PCl5,所以c(PCl5)<0.8 molL﹣1,则达平衡时,容器Ⅲ中0.4 molL﹣1<c(PCl5)<0.8 molL﹣1,故D正确,
故答案为BD。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】实验室处理废催化剂FeBr3溶液,得到溴的苯溶液和无水FeCl3。下列设计能达到相应实验目的的是
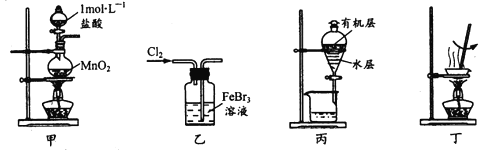
A.用装置甲制取氯气
B.用装置乙使Br-全部转化为溴单质
C.用装置丙分液时先从下口放出水层,再从上口倒出有机层
D.用装置丁将分液后的水层蒸发至干,再灼烧制得无水FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓硫酸配制1.0mol/L硫酸溶液480mL,回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 ______(填字母),配制上述溶液还需用到的玻璃仪器是_________(填仪器名称)。

(2)容量瓶上标有以下5项中的_____(填序号)
①压强 ②温度 ③容量 ④浓度 ⑤刻度线
(3)在配制过程中,下列操作使所配溶液浓度偏大的是__________ .
①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
②定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
③定容时,仰视刻度线
④使用容量瓶前用蒸馏水洗涤且没干燥
(4)计算实验室配制上述溶液需用量筒量取质量分数为98%、密度为1.84g/mL的浓硫酸的体积为:_____mL。(保留小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是
A.利用图 方法验证装置的气密性
方法验证装置的气密性
B.实验室里利用图 装置制备氯气
装置制备氯气
C.利用图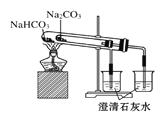 比较碳酸钠和碳酸氢钠的热稳定性
比较碳酸钠和碳酸氢钠的热稳定性
D.利用图 制备Fe(OH)2并能较长时间观察其颜色
制备Fe(OH)2并能较长时间观察其颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A.0.1 mol N2的质量是2.8 g
B.常温常压下,22 g CO2中所含氧原子数约为6.02×1023
C.2 L 0.1mol·L-1NaCl溶液中,c(Na+)=0.2mol·L-1
D.标准状况下,11.2 L O2含有的原子数目约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有一瓶无色澄清溶液,其中可能含H+、Na+、Mg2+、Ba2+、Cl、SO42、CO32离子。现进行以下实验:
A、用pH试纸检验溶液,发现溶液呈强酸性;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生;
C、取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生。
①根据上述事实确定:该溶液中肯定存在的离子有_________________________;
肯定不存在的离子有___________________________。
②写出C中发生反应的离子方程式________________________________。
(2)①还原铁粉与高温水蒸气反应的化学方程式:_____________________________;
②除去Mg粉中的Al粉的试剂是__________________,反应的离子方程式为:___________________________________;
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
____Fe(OH)3 +____ClO-+____OH- =__FeO42-+___Cl-+_____ _______
(4)在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,氧化剂是___________;
当有2mol H3PO4生成,转移的电子的物质的量为__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I下面是几种实验中常用的仪器:

写出序号所代表的仪器的名称:
A__________;B__________;C__________;D__________;E__________
II实验室要配制100 mL 2 mol/L NaCl溶液,请回答下列问题:
(1)配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、天平、量筒和__________________。
(2)用托盘天平称取氯化钠固体,其质量为__________g。
(3)下列主要操作步骤的正确顺序是____________________(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会造成所配溶液的物质的量浓度__________ (填“偏高”或“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.H2SO4酸化的KI溶液中加入H2O2:2I-+H2O2+2H+=I2+2H2O
B.SO2通入BaCl2溶液中:SO2+Ba2++H2O=BaSO3↓+2H+
C.(NH4)2Fe(SO4)2溶液中加入少量NaOH溶液:NH4++OH-=NH3·H2O
D.用CuCl2溶液做导电性实验,灯泡发光:CuCl2![]() Cu2++2Cl-
Cu2++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1000mol·L-1NaOH溶液滴定20mL0.1000mol·L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示。下列说法正确的是

A.当滴入40mLNaOH溶液时,溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
B.当溶液中c(H+)+c(OH-)=2×10-7时:c(Na+)>c(A-)>c(OH-)=c(H+)
C.当滴入NaOH溶液20mL时c(OH-)>c(H+)+c(HA)
D.当滴定到pH=4.75时,c(A-)=c(HA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com