
| A. | 向NaOH溶液中通入过量的CO2:CO2+OH-═HCO3- | |
| B. | 将SO2气体通入Ba(NO3)2溶液:SO2+H2O+Ba2+═BaSO3↓+2H+ | |
| C. | 实验室制氯气:MnO2+4HCl(浓)═Mn2++2Cl2↑+2H2O | |
| D. | AlCl3溶液与过量氨水混合:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
分析 A.反应生成碳酸氢钠;
B.发生氧化还原反应生成硫酸钡、NO;
C.盐酸完全电离;
D.反应生成氢氧化铝和氯化铵.
解答 解:A.向NaOH溶液中通入过量的CO2的离子反应为CO2+OH-═HCO3-,故A正确;
B.将SO2气体通入Ba(NO3)2溶液中的离子反应为Ba2++2NO3-+3SO2+2H2O═BaSO4↓+2NO↑+4H++2SO42,故B错误;
C.实验室制氯气的离子反应为MnO2+4H++2Cl-═Mn2++2Cl2↑+2H2O,故C错误;
D.AlCl3溶液与过量氨水混合的离子反应为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:选择题
| A. |  ? ?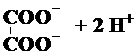 | B. | Ba(OH)2?Ba2++2OH- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | NaHCO3═Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.
宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图.该电池电池表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图.该电池电池表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol氯气与金属铁完全反应时,转移电子数为0.2NA | |
| B. | 100mL 1mol/L NaHCO3溶液含有0.1NA个HCO3- | |
| C. | 7.1g氯气与足量NaOH溶液反应电子转移数为0.2NA | |
| D. | 0.1molNa2O2中含有的离子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 直接甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.
直接甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把烧杯放在垫有石棉网的铁圈上加热 | |
| B. | 为了不造成浪费,实验剩余的药品放回原瓶 | |
| C. | 用100ml量筒量取8.5ml的水 | |
| D. | 用燃着的酒精灯去点燃另一酒精灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCHO | B. | CH3OH | C. | HOOCCOOH | D. | 纤维素(C6H10O5)n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,若反应中生成0.2mol HNO3,转移的电子数目为0.4NA或2.408×1023个;
,若反应中生成0.2mol HNO3,转移的电子数目为0.4NA或2.408×1023个;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com