
【题目】氮的重要化合物如氨(NH3)、氮氧化物(NxOx)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1)①NH3催化氧化可制备硝酸。
4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH1=-907.28 kJ·mol-1
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH2=-1269.02 kJ·mol-1
则4NH3(g)+6NO(g)===5N2(g)+6H2O(g) ΔH3=________________。
②NO被O2氧化为NO2。其他条件不变时,NO的转化率[α(NO)]与温度、压强的关系如下图所示。则p1________p2(填“>”“<”或“=”);温度高于800℃时,α(NO)几乎为0的原因是______________________________。

③在500℃温度时,2L密闭容器中充入2molNO和1molO2,达平衡时压强为P2MPa。则500℃时该反应的平衡常数Kp=_____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
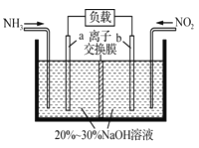
(2)利用反应NO2+NH3→N2+H2O(未配平)消除NO2的简易装置如下图所示。电极b的电极反应式为_________________,消耗标准状况下4.48LNH3时,被消除的NO2的物质的量为____________mol。
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如下图所示。
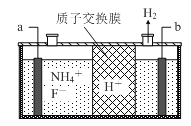
①a电极为电解池的_____________(填“阴”或“阳”)极,写出该电极的电极反应式:_____________;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是_____________________。
②已知氨水电离常数Kb=1.8×10-5,氢氟酸电离常数Ka=3.5×10-4,则NH4F的电子式为_____________,0.1mol/LNH4F溶液中所有离子浓度由大到小的顺序为_____________________________。
【答案】 -1811.63 kJ·mol-1 > NO2几乎完全分解 7/32P2 MPa-1 2NO2+8e-+4H2O===8OH-+N2 0.15 阳 NH4++3F--6e-=NF3+4H+ F2 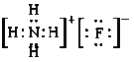 c(F-)> c(NH4+)> c(H+)> c(OH-)
c(F-)> c(NH4+)> c(H+)> c(OH-)
【解析】(1)①i.4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJmol-1;ii.4NH3(g)+3O2(g) ═2N2(g) +6H2O(g) △H2=-1269.02kJmol-1;目标反应的反应热为: ![]() =1811.63kJmol-1,故答案为:=-1811.63kJmol-1;
=1811.63kJmol-1,故答案为:=-1811.63kJmol-1;
②温度相同时p1的一氧化氮的转化率大,所以增大压强平衡正向移动,所以p1>p2;NO被O2氧化为NO2,方程式为:2NO+O2![]() 2NO2;α(NO)几乎为0表示无二氧化氮,说明NO2几乎完全分解,故答案为:>;NO2几乎完全分解;
2NO2;α(NO)几乎为0表示无二氧化氮,说明NO2几乎完全分解,故答案为:>;NO2几乎完全分解;
③500℃温度时,达平衡时压强为P2MPa,α(NO)=0.2,
2NO + O2![]() 2NO2
2NO2
起始(mol) 2 1 0
反应(mol) 0.4 0.2 0.4
平衡(mol) 1.6 0.8 0.4
平衡分压(MPa) ![]() P2
P2 ![]() P2
P2 ![]() P2
P2
平衡常数Kp=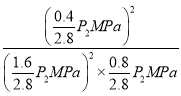 =
=![]() ,故答案为:
,故答案为: ![]() ;
;
(2)配平后的方程式为6NO2+8NH3=7N2+12H2O。电极b的电极发生还原反应,二氧化氮转化生成氮气,电极反应式为2NO2+8e-+4H2O═8OH-+N2;标准状况下4.48LNH3的物质的量为:0.2mol,根据4NH3~3NO2,所以被消除的NO2的物质的量为![]() ×0.2mol=0.15mol,故答案为:2NO2+8e-+4H2O═8OH-+N2;0.15;
×0.2mol=0.15mol,故答案为:2NO2+8e-+4H2O═8OH-+N2;0.15;
(3)①由图2可知,H+在b极上得到电子生成氢气,故b为阴极,那么a为阳极,阳极上NH4+失去电子生成NF3,电极反应方程式为:NH4++3F--6e-=NF3+4H+,依据电解原理可知,F-也可能失去电子生成氟单质,故氧化性较强的单质为氟气,故答案为:阳;NH4++3F--6e-=NF3+4H+;F2;
②NH4F属于离子化合物,电子式为 ,氨水电离常数Kb=1.8×10-5,氢氟酸电离常数Ka=3.5×10-4,说明HF的电离程度大于NH3H2O,则NH4F溶液中NH4+水解程度大于F-,溶液显酸性,离子浓度由大到小的顺序为c(F-)> c(NH4+)> c(H+)> c(OH-),故答案为:
,氨水电离常数Kb=1.8×10-5,氢氟酸电离常数Ka=3.5×10-4,说明HF的电离程度大于NH3H2O,则NH4F溶液中NH4+水解程度大于F-,溶液显酸性,离子浓度由大到小的顺序为c(F-)> c(NH4+)> c(H+)> c(OH-),故答案为: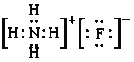 ;c(F-)> c(NH4+)> c(H+)> c(OH-)。
;c(F-)> c(NH4+)> c(H+)> c(OH-)。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】CH4既是一种重要的能源,也是一种重要的化工原料.
(1)已知8.0g CH4完全燃烧生成液体水放出444.8kJ热量.则CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=kJmol﹣1
(2)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理图1所示,则通入a气体的电极名称为 , 通入b气体的电极反应式为 . (质子交换膜只允许H+通过)
(3)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向.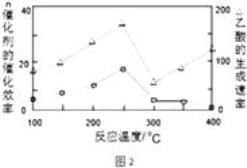
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图2所示,则该反应的最佳温度应控制在 左右.
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2 , 难溶物).将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为 .
(4)CH4还原法是处理NOx气体的一种方法.已知一定条件下CH4与NOx反应转化为N2和CO2 , 若标准状况下8.96L CH4可处理22.4L NOx,则x值为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. H2S溶液显酸性:H2S+2H2O![]() 2H3O++S2-
2H3O++S2-
B. 将少量二氧化硫通入次氯酸钠溶液中:SO2+H2O+3ClO-=SO42-+Cl-+2HC1O
C. 向Ca(HCO3)2溶液中加入澄清石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
D. 向FeI2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素有多种可变化合价,可组成多种含氧酸盐,这些盐的命名和卤素的化合价有关,如次卤酸盐(含XO-)、卤酸盐(XO3-)、高卤酸盐(XO4-)等,有一种碘和氧的化合物可以称为碘酸碘,其中碘元素呈+3、+5两种价态,则这种化合物的化学式是( )
A.I2O4B.I3O5C.I4O7D.I4O9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.若酸式滴定管旋塞处的小孔被凡士林严重堵塞,可以用细铁丝疏通
B.镀锌铁皮与稀硫酸反应,若产生的气泡突然消失,锌反应完全,需立即取出铁皮
C.液溴存放在带玻璃塞的棕色细口瓶中,并加水液封,放在阴凉处
D.若皮肤被烫伤且已破,可先涂些紫药水或1%高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求用化学用语回答下列问题:
(1)除去混入Fe2O3粉末中少量Al2O3杂质的试是 , 离子方程式为 .
(2)在呼吸面具中,Na2O2起反应的化学方程式为 .
(3)镁带着火时,不能用液态CO2灭火剂来灭火的原因是 . (用化学方程式表示).
(4)氯气用于漂白、消毒时,能起漂白、消毒作用的物质是(写化学式).
某研究性学习小组对漂白液进行了如下实验探究:取漂白液少量,滴入3~5滴紫色石蕊试液,发现溶液先变蓝色后褪色,可以证明漂白液具有的性质有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关乙酸与甲酸甲酯的说法中不正确的是 ( )
A. 两者都可以和NaOH溶液反应 B. 可利用水将两者区分开
C. 两者互为同分异构体 D. 两者互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com