
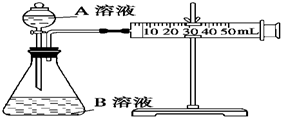
 甲、乙、丙三个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲、乙、丙三个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):| 序号 | A溶液 | B溶液 |
| ① | 2mL0.1mol/LH2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ② | 2mL0.2mol/LH2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| 序号 | 溶液 | 条件 |
| ③ | 2mL 0.1mol/L H2C2O4和8mL 0.1mol/L KMnO4 | 热水 |
| ④ | 2mL 0.1mol/L H2C2O4和8mL 0.1mol/L KMnO4 | 冷水 |
| 时间(min) | 0-4 | 4-8 | 8-12 | 12-16 | 16-21 | 21-22 | 22-23 |
| c(KMnO4)(10-4mol/L) | 4.58 | 4.02 | 3.36 | 2.25 | 0.72 | 0.43 | 0.23 |
| υ(KMnO4)(10-4mol/(L•min) | a | 0.14 | 0.17 | 0.28 | 0.32 | 0.29 | 0.20 |
分析 (1)从改变的条件看,H2C2O4浓度从0.1到0.2mol/L,故为浓度对化学反应速率的影响;判断反应速率需要时间,用秒表计时;
(2)①实验中除温度不同外,其他条件都相同;
②高锰酸钾具有强氧化性,能把草酸氧化成二氧化碳,自身被还原成二价锰离子;根据草酸和高锰酸钾反应的方程式分析数据可知高锰酸钾过量;
(3)根据反应速率v=$\frac{△c}{△t}$计算速率的大小;溶液温度几乎不变,从数据看出反应的速率开始阶段速率却在增大,可判断是催化剂的影响.
解答 解:(1)从改变的条件看,H2C2O4浓度从0.1到0.2mol/L,故为浓度对化学反应速率的影响;判断反应速率v=$\frac{△c}{△t}$,需要测定时间,可用秒表计时,
故答案为:浓度;秒表;
(2)①实验中除温度不同外,其他条件都相同,可知该实验探究的是温度对反应速率的影响,
故答案为:温度;
②高锰酸钾具有强氧化性,把草酸中的C从+3价氧化成+4价的二氧化碳,Mn元素从+7价变化到+2价的锰离子,由于草酸分子中有2个C原子,所以高锰酸钾与草酸的反应比例为 2:5,故反应的方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
草酸的物质的量为:0.002L×0.1mol•L-1=2×10-4mol,高锰酸钾的物质的量为:0.008L×0.1mol•L-1=8×10-4mol,由方程式可知,高锰酸钾过量,故没看到溶液褪色,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O;高锰酸钾过量;
(3)反应速率v=$\frac{△c}{△t}$=$\frac{\frac{0.04L×0.001mol/L}{0.08L}-4.58×1{0}^{-4}mol/L}{4min}$=0.11×10-4mol/(L•min),溶液温度几乎不变,从数据看出反应的速率开始阶段速率却在增大,可判断是反应过程中产生了催化剂加快了反应速率,
故答案为:0.11;反应过程中产生了催化剂加快了反应速率.
点评 本题以探究实验为基础,考查影响化学反应速率的因素、氧化还原反应基础知识等,试题侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 2.0gH218O与D2O的混合物中所含中子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 分离方法 | 原理 | |
| A | 除去乙烯中乙炔:通入酸性高锰酸钾溶液中洗气 | 乙炔能与酸性高锰酸钾溶液反应,而乙烯不反应 |
| B | 分离硝基苯和苯:蒸馏 | 硝基苯和苯的沸点不同 |
| C | 除去丁酸乙酯中乙醇:加入饱和碳酸钠溶液,蒸馏 | 乙醇和丁酸乙酯的沸点不同 |
| D | 用丙醇和氯仿萃取碘水中碘 | 碘易溶于丙醇、氯仿 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,加入适量稀盐酸或稀硫酸,在溶液中加入硫氰化钾溶液 | 溶液不变红色,则假设一成立,溶液变成红色,则假设一不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=3和pH=5的硫酸溶液等体积混合,所得溶液的pH约为3.3 | |
| B. | 1 L 0.5 mo1•L-1稀硫酸与1 L 1 mo1•L-1NaOH溶液混合反应放出57.3 kJ的热量,则表示中和热的热化学方程式为: H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1),△H=-114.6 kJ•mo1-l | |
| C. | 已知室温时,0.1 mol•L-1某一元酸HA的电离平衡常数约为1×10-7,则该酸的电离度为0.01% | |
| D. | 已知常温下Ag2CrO4的Ksp=1.12×10-12.将等体积的2×10-4mol•L-1 AgNO3溶液和2×10-4 mol•L-1 K2CrO4溶液混合,则有Ag2CrO4沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.92g | B. | 1.68g | C. | 2.12g | D. | 2.55g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断正确的是( )| A. | 最简单氢化物的稳定性:R>Q>X;R>T>X | |
| B. | 五种元素中Z的活动性最弱,T的氧化物对应水化合物酸性最强 | |
| C. | Q单质能从溶液中置换出X单质,R单质能从溶液中置换出T单质 | |
| D. | X阴离子和T阴离子相比,半径:X阴离子的大;还原性:T阴离子的强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com