

| A. | 该铅蓄电池正在充电 | |
| B. | 工作一段时间后,溶液的pH不断减小 | |
| C. | a为铅蓄电池的正极 | |
| D. | b电极发生的反应为PbO2+4H++SO42-+2e-═PbSO4+2H2O |
分析 铅蓄电池的电极材料分别为Pb和PbO2,放电时负极电极反应为Pb-2e-+SO42-=PbSO4 ,正极电极反应为PbO2+2e-+4H++SO42-=PbSO4+2H2O,可知正极质量增加的多,则a为Pb,b为PbO2,总反应为Pb+PbO2+2H2SO4=2PbSO4↓+2H2O,以此来解答.
解答 解:A.为原电池,则该铅蓄电池正在放电,故A错误;
B.由Pb+PbO2+2H2SO4=2PbSO4↓+2H2O可知,氢离子浓度减小,pH增大,故B错误;
C.放电时负极电极反应为Pb-2e-+SO42-=PbSO4 ,正极电极反应为PbO2+2e-+4H++SO42-=PbSO4+2H2O,可知正极质量增加的多,则a为Pb,故C错误;
D.b为正极,正极电极反应PbO2+2e-+4H++SO42-=PbSO4+2H2O,故D正确;
故选D.
点评 本题考查原电池及工作原理,为高频考点,把握电极反应、由质量变化判断电极等为解答的关键,侧重分析与应用能力的考查,注意电极反应的书写,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

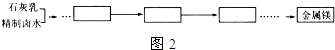
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜中含有大量的有机物,可采用灼烧的方法除去有机物 | |
| B. | 灼烧后含有少量铜的可能原因是该条件下铜无法被氧气氧化 | |
| C. | 通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、蒸发、冷却结晶、过滤、自然干燥 | |
| D. | 与途径II相比,产生等量的胆矾途径I消耗硫酸少,途径I不会产生污染大气的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
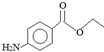
| A. | M分子式为C8H11NO2 | |
| B. | 1mol M与NaOH溶液反应消耗1mol NaOH | |
| C. | M与盐酸的反应属于加成反应 | |
| D. | 与M含有相同官能团的同分异构体有8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子 | |
| B. | 食用地沟油对人体的危害极大,原因主要是里面含有黄曲霉素和甘油三酯 | |
| C. | 地球上CH4、CO2等气体含量上升容易导致温室效应,进而引发灾难性气候 | |
| D. | 保鲜膜、一次性食品袋的主要成分是聚氯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com