
分析 氧化还原反应中失电子的元素化合价升高,得电子的元素化合价降低,化合价降低数目=化合价升高数目=转移的电子数目,化合价降低元素所在的反应物是氧化剂,化合价降低元素所在的生成物是还原产物,据此表示电子转移的方向和数目.
解答 解:(1)2HCl+Zn═ZnCl2+H2↑中失电子的Zn元素化合价升高,得电子的H元素化合价降低,化合价降低数目=化合价升高数目=转移的电子数目=2,电子转移情况如下: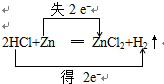 ,故答案为:
,故答案为: ;
;
(2)3Cl2+6KOH═5KCl+KClO3+3H2O中失电子的Cl元素化合价升高,得电子的Cl元素化合价降低,化合价降低数目=化合价升高数目=转移的电子数目=5,电子转移情况如下: ,故答案为:
,故答案为: ;
;
(3)氧化还原反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中失电子的元素是铜元素,化合价升高,得电子的元素是氮元素,化合价降低,转移的电子数目为6mol,电子转移情况为: ,故答案为:
,故答案为: ;
;
(4)SO2+2H2O+Cl2═H2SO4+2HCl中失电子的元素是S元素,化合价升高,得电子的元素是Cl元素,化合价降低,转移的电子数目为2mol,电子转移情况为: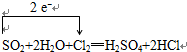 ,故答案为:
,故答案为: .
.
点评 本题考查氧化还原反应的特征和实质以及电子转移数目的判断知识,是对教材知识的考查,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液呈浅绿色 | |
| B. | 该溶液中加入NaOH溶液,生成白色沉淀并迅速变成灰绿色,最后变为红褐色 | |
| C. | 向该溶液中加入氯水,再滴入几滴KSCN溶液,呈红色 | |
| D. | 向该溶液中滴入几滴KSCN溶液,不变色,再加入氯水,呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合溶液中c(Na+)=0.2 mol•L-1 | |
| B. | 电解后溶液中c(H+)=0.4mol•L-1 | |
| C. | 上述电解过程中共转移0.4 mol电子 | |
| D. | 电解后得到的Cu的物质的量为0.05mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
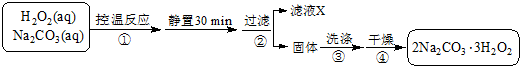
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
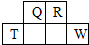 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T的单质既可与盐酸反应,又可与NaOH溶液反应,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T的单质既可与盐酸反应,又可与NaOH溶液反应,请回答下列问题: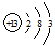 .
.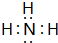
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
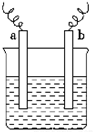 如图中,两电极上发生的电极反应如下:a极:Cu2++2e-═Cu;b极:Fe-2e-═Fe2+,则以下说法中不正确的是( )
如图中,两电极上发生的电极反应如下:a极:Cu2++2e-═Cu;b极:Fe-2e-═Fe2+,则以下说法中不正确的是( )| A. | 该装置一定是原电池 | |
| B. | a极上一定发生还原反应 | |
| C. | a、b可以是同种电极材料 | |
| D. | 该过程中能量的转换可以是电能转化为化学能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com