
| A、①④ | B、①②③ |
| C、②③④ | D、①②③④ |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、升高温度,正反应速率减小,逆反应速率增加,平衡逆向移动 |
| B、升高温度,可提高CO2转化率 |
| C、增加H2的浓度,可提高CO2转化率 |
| D、改用高效催化剂,可增大反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:

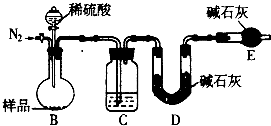
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
| B、FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O |
| C、大理石溶于醋酸中的反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、等物质的量的NaHCO3和Ca(OH)2溶液混合:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述四种元素的原子半径大小为W<X<Y<Z<M |
| B、由这些元素形成的三原子分子中,空间结构为直线形的有WX2,WZ2,ZX2 |
| C、元素W与氢形成的原子个数比为1﹕1的化合物有很多种 |
| D、X与Y可形成含有非极性共价键的共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、Cl2+2KBr═Br2+2KCl |
| B、2NaHCO3?Na2CO3+H2O+CO2 |
| C、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
| D、2Na2O2+2CO2═2Na2CO3+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若a=b,pH(NaX)>pH(NaY),则相同浓度时,酸性HX>HY |
| B、若a=b,并测得c(X-)=c(Y-)+c(HY);则相同浓度时,酸性HX>HY |
| C、若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时,酸性HX<HY |
| D、若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol?L-1,则可推出a+b=0.2mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向某钾盐中加入澄清石灰水 | 有白色沉淀生成 | 该钾盐是K2CO3 |
| B | 在酸性KMnO4溶液中通入SO2 | 酸性KMnO4溶液褪色 | SO2具有漂白性 |
| C | 向溶液X中先滴加稀硝酸,再滴加硝酸钡溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
| D | 向装有Fe(NO3)2溶液的试管中加入稀硫酸 | 在管口看到红棕色气体 | 氧化还原生成NO被氧化成NO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com