
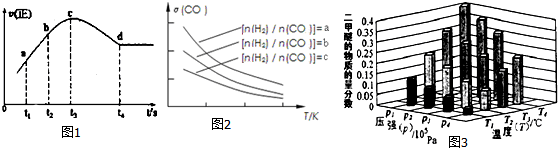
分析 (1)①根据CO转化率计算消耗CO物质的量,根据v=$\frac{△c}{△t}$计算v(CO),再根据速率之比等于化学计量数之比计算v(N2);
②由题目信息可知,用某组分(B)的平衡压强(PB)表示平衡常数为:生成物分压的系数次幂乘积与反应物分压系数次幂乘积的比;
③正反应为气体物质的量减小的反应,为熵减反应,而△H-T△S<0反应自发进行;
④从t4时刻正反应速率不变,处于平衡状态,t4时刻前未到达平衡,反应向正反应进行,由③中可知为反应热反应,绝热条件下,随反应进行温度升高,温度起主导作用,反应速率加快,而后浓度为主导因素,反应速率减低至平衡状态;
(2)使根据K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$计算平衡常数,恒温恒压下计算加入3molCO时容器体积,再计算浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行;
(3)①增大H2的浓度,平衡右移,CO的转化率增大;
②通过图2可知,温度升高CO的转化率降低,说明升温平衡逆向移动,故正反应方向为放热反应,则温度越高二甲醚的质量分数越小;
正反应为气体体积减小的反应,增大压强平衡正向移动,二甲醚的质量分数增大;
③A.增大反应物浓度,平衡正向移动,正反应速率先增大后减小;
B.逆反应速率先增大后减小,说明平衡逆向移动;
C.化学平衡常数K值增大,说明平衡正向移动;
D.反应物的体积百分含量增大,说明平衡正向移动;
E.移走生成物的量,平衡正向移动,混合气体总质量减小,容器容积不变,混合气体密度减小;
F.增大氢气的物质的量,平衡正向移动,但氢气转化率减小.
解答 解:(1)①消耗CO物质的量为1.2mol×20%=0.24mol,v(CO)=$\frac{\frac{0.24mol}{2L}}{2min}$=0.06mol/(L.min),速率之比等于化学计量数之比,则v(N2)=$\frac{1}{2}$v(CO)=0.03mol/(L.min),
故答案为:0.03mol/(L.min);
②由题目信息可知,用某组分(B)的平衡压强(PB)表示平衡常数为:生成物分压的系数次幂乘积与反应物分压系数次幂乘积的比,2NO(g)+2CO(g)?2CO2(g)+N2(g)用某组分(B)的平衡压强(PB)表示平衡常数KP=$\frac{{p}^{2}(C{O}_{2})P({N}_{2})}{{P}^{2}(NO)×{P}^{2}(CO)}$,
故答案为:$\frac{{p}^{2}(C{O}_{2})P({N}_{2})}{{P}^{2}(NO)×{P}^{2}(CO)}$;
③正反应为气体物质的量减小的反应,为熵减反应,△S<0,而△H-T△S<0反应自发进行,该反应在低温下能自发进行,该反应的△H<0,
故答案为:<;
④从t4时刻正反应速率不变,处于平衡状态,t4时刻前未到达平衡,反应向正反应进行,由③中可知为反应热反应,绝热条件下,随反应进行温度升高,温度起主导作用,反应速率加快,而后浓度为主导因素,反应速率减低至平衡状态;
A.反应在c点未达到平衡状态,故A正确;
B.由图可知,反应速率a点小于b点,故B正确;
C.反应物浓度a点大于b点,故C正确;
D.NO的转化率:t1~t2<t2~t3,故D错误,
故选D,
故答案为:D;
(2)温度不变,平衡常数不变,平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{\frac{1}{3}}{\frac{1}{3}×(\frac{1}{3})^{2}}$=9,通入3mol CO瞬间体积变为3L×$\frac{6}{3}$=6L,浓度商Qc=$\frac{\frac{1}{6}}{\frac{4}{6}×(\frac{1}{6})^{2}}$=9=K,平衡不移动,故v(正)=v(逆),
故答案为:=;温度不变,平衡常数不变,平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{\frac{1}{3}}{\frac{1}{3}×(\frac{1}{3})^{2}}$=9,通入3mol CO瞬间体积变为3L×$\frac{6}{3}$=6L,浓度商Qc=$\frac{\frac{1}{6}}{\frac{4}{6}×(\frac{1}{6})^{2}}$=9=K,平衡不移动;
(3)①增大H2的浓度,平衡右移,CO的转化率增大,故有a>b>c,
故答案为:a>b>c;
②通过图2可知,温度升高CO的转化率降低,说明升温平衡逆向移动,故正反应方向为放热反应,则温度越高二甲醚的质量分数越小,故温度:T1>T2>T3>T4;
正反应为气体体积减小的反应,增大压强平衡正向移动,二甲醚的质量分数增大,故压强P1>P2>P3>P4,
故选BD,
故答案为:BD;
③A.增大反应物浓度,平衡正向移动,正反应速率先增大后减小,不一定逆向移动,故A错误;
B.逆反应速率先增大后减小,说明平衡逆向移动,故B正确;
C.化学平衡常数K值增大,说明平衡正向移动,故C错误;
D.反应物的体积百分含量增大,说明平衡逆向移动,故D正确;
E.移走生成物的量,平衡正向移动,混合气体总质量减小,容器容积不变,混合气体密度减小,故E错误;
F.增大氢气的物质的量,平衡正向移动,但氢气转化率减小,故F错误,
故选:BD.
故答案为:BD.
点评 本题考查化学平衡计算与影响因素、化学平衡图象、平衡状态建立、反应速率计算、平衡常数应用等,是对学生综合能力考查,题目难度中等,学生容易忽略体积变化.


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O所含原子个数大于3NA | |
| B. | 100ml18.4mol/L硫酸与足量Cu反应,生成SO2的分子数为0.92NA | |
| C. | t℃时,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×10-3NA | |
| D. | 100g质量分数为34.2%的蔗糖分子水溶液中含H原子数为2.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
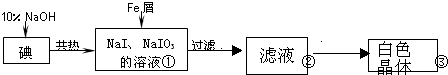
| 实验方案 | 实验现象 | 结论 |
| 将白色晶体溶于水,并滴2滴淀粉溶液 | 得到无色溶液 | / |
| 取少量溶液液于试管A中,加入足量的1mol/LH2SO4. | 溶液显蓝色 | 溶液中含IO3- |
| 另取少量溶液液于试管B中,滴入几滴酚酞溶液. | 溶液变红. | 溶液中含大量0H- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ②③④ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2C2H6(g)+7O2 (g)=4CO2 (g)+6H2O(l);△H=-1190KJ/mol | |
| B. | C2H6(g)+$\frac{7}{2}$O2 (g)=2CO2 (g)+3H2O(g);△H=-1190KJ/mol | |
| C. | 298k、101kPa时,30g乙烷气体完全燃烧生成CO2气体和液态水,放出1190kJ热量 | |
| D. | 该反应中,反应物所具有的总能量小于生成物所具有的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com