分析:(1)根据盖斯定律来解答;
(2)①由图可知,温度一定时,甲烷的转化率α(P
1)>α(P
2)>α(P
3)>α(P
4),据此结合方程式判断压强对平衡移动的影响进行解答;
②由图1可知,压强为P
4、1100℃的条件下,该反应5min时达到平衡X点,是甲烷的转化率为80%,据此计算甲烷的浓度变化量,根据v=
计算v(CH
4),再利用速率之比等于化学计量数之比计算v(CO);
利用三段式计算平衡时各组分的平衡浓度,代入平衡常数表达式计算该温度下的平衡常数;
(3)①可逆反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,据此解答.解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
②根据增大压强,平衡向着气体体积减小的方向移动来分析.
解答:
解:(1)已知反应①2CO(g)+O
2(g)═2CO
2(g)△H=-566kJ?mol
-1 ②2H
2(g)+O
2(g)═2H
2O(g)△H=-484kJ?mol
-1 ③CH
4(g)+2O
2(g)═CO
2(g)+2H
2O(g)△H=-802kJ?mol
-1根据盖斯定律,将③-①-②可得:
CH
4(g)+CO
2(g)?2CO(g)+2H
2(g)△H=(-802kJ?mol
-1)-(-566kJ?mol
-1)-(-484kJ?mol
-1)=+248KJ/mol,
故答案为:+248;
(2)由图可知,温度一定时,甲烷的转化率α(P
1)>α(P
2)>α(P
3)>α(P
4),该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,故压强P
4>P
3>P
2>P
1;
由图1可知,压强为P
4、1100℃的条件下,该反应5min时达到平衡X点,是甲烷的转化率为80%,甲烷的浓度变化量为0.1mol/L×80%=0.08mol/L,故v(CH
4)=
=0.016mol/(L?min),根据速率之比等于化学计量数之比,所以v(CO)=2v(CH
4)=2×0.16mol/(L?min)=0.032mol/(L?min),
CH
4(g)+CO
2(g)=2CO(g)+2H
2(g),
开始(mol/L):0.1 0.1 0 0
变化(mol/L):0.08 0.08 0.16 0.16
平衡(mol/L):0.02 0.02 0.16 0.16
故该温度下平衡常数k=
=1.64
故答案为故答案为:P
4>P
3>P
2>P
1;0.032mol/(L?min);1.64;
(3)①A、正反应方向是个气体体积增大的方向,故随着反应的进行,平衡之前,体系压强会增大,故一旦当体系压强不变,说明反应达平衡,故A正确;
B、CO与H
2的化学计量数为1:1,反应数值按物质的量比为1:1进行,不能说明到达平衡,故B错误;
C、混合气体的密度ρ=
,容器恒容,即V不变,随着反应的进行,混合气体的质量m增大,故ρ增大,一旦当ρ不变时,说明反应达平衡,故C正确;
D、反应混合物的总质量不变,随反应进行,反应混合物的总的物质的量增大,平均相对分子质量减小,混合气体的平均相对分子质量不发生变化,说明到达平衡,但达平衡时,平均相对分子质量不一定是15,故D错误;
故选AC;
②根据勒沙特列原理可知,增大压强,平衡向着气体体积减小的方向移动,此反应的逆反应方向是个气体体积减小的方向,故增大压强,向逆反应方向移动;
在第2min时,混合气体的平均相对分子质量即平均摩尔质量
=
=
=12g/mol.
设在第2~5min期间的任何时刻,有XmolH
2被消耗,则有:
C(s)+H
2O(g)?CO(g)+H
2(g)
初始量(mol) 1 1 2.2
转变量(mol) X X X
剩余量(mol) (1+X) (1-X) (2.2-X)
混合气体的平均相对分子质量即平均摩尔质量
=
=
| 18(1+X)+28(1-X)+2(2.2-X) |
| (1+X)+(1-X)+(2.2-X) |
=12,故可知在2~5min期间的任意时刻,混合气体的平均相对分子质量不变,一直是12,故可得2~5min内容器中气体平均相对分子质量的变化曲线为
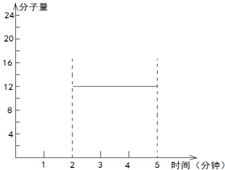
,
故答案为:

.


 ,
, .
.


 I.氨分子的空间构型为
I.氨分子的空间构型为