
”¾ĢāÄæ”æ(1)¼×“¼![]() ŹĒÖŲŅŖµÄČܼĮŗĶĢę“śČ¼ĮĻ£¬¹¤ŅµÉĻÓĆCOŗĶH2ŌŚŅ»¶ØĢõ¼žĻĀÖʱø
ŹĒÖŲŅŖµÄČܼĮŗĶĢę“śČ¼ĮĻ£¬¹¤ŅµÉĻÓĆCOŗĶH2ŌŚŅ»¶ØĢõ¼žĻĀÖʱø![]() µÄ·“Ó¦£ŗ
µÄ·“Ó¦£ŗ![]() £¬ŌŚĢå»żĪŖ1LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ£¬³ä2molCOŗĶ
£¬ŌŚĢå»żĪŖ1LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ£¬³ä2molCOŗĶ![]() £¬Ņ»¶ØĢõ¼žĻĀ·¢ÉśÉĻŹö·“Ó¦£¬²āµĆ
£¬Ņ»¶ØĢõ¼žĻĀ·¢ÉśÉĻŹö·“Ó¦£¬²āµĆ![]() ŗĶ
ŗĶ![]() µÄÅضČĖꏱ¼ä±ä»ÆČēĶ¼ĖłŹ¾”£
µÄÅضČĖꏱ¼ä±ä»ÆČēĶ¼ĖłŹ¾”£
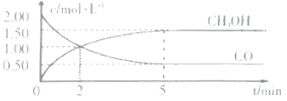
¢Ł“Ó·“Ó¦æŖŹ¼µ½5min£¬ÓĆŅ»Ńõ»ÆĢ¼±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹ¦Ō£ØCO£©=______”£
¢ŚĻĀĮŠĖµ·ØÕżČ·µÄŹĒ______”£
A.“ļµ½Ę½ŗāŹ±£¬![]() µÄ×Ŗ»ÆĀŹĪŖ
µÄ×Ŗ»ÆĀŹĪŖ![]()
B.5minŗóČŻĘ÷ÖŠ»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»ŌŁøıä
C.“ļµ½Ę½ŗāŗó£¬ŌŁ³äČė°±Ęų£¬·“Ó¦ĖŁĀŹ¼õŠ”
D.2minĒ°¦Ō£ØÕż£©>¦Ō£ØÄę£©£¬2minŗó¦Ō£ØÕż£©<¦Ō£ØÄę£©
(2)Ņ»¶ØĪĀ¶ČĻĀ£¬½«![]() Óė
Óė![]() ŅŌĢå»ż±Č1£ŗ2ÖĆÓŚĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£ŗ
ŅŌĢå»ż±Č1£ŗ2ÖĆÓŚĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£ŗ
![]() £¬“ļµ½Ę½ŗāŹ±
£¬“ļµ½Ę½ŗāŹ±![]() µÄĢå»ż·ÖŹżĪŖ
µÄĢå»ż·ÖŹżĪŖ![]() £¬øĆ·“Ó¦µÄĘ½ŗā³£Źż
£¬øĆ·“Ó¦µÄĘ½ŗā³£Źż![]() ______”£
______ӣ
(3)Ģ¼ÓėĖ®ÕōĘų·“Ó¦ÖĘČ”![]() µÄĻą¹Ų·“Ó¦ČēĻĀ£ŗ
µÄĻą¹Ų·“Ó¦ČēĻĀ£ŗ
¢ń![]()
¢ņ![]()
¢ó![]()
¢Ł¼ĘĖć·“Ó¦![]() µÄ
µÄ![]() ______
______![]()
¢Ś¶ŌÓŚæÉÄę·“Ó¦![]() £¬²ÉČ”ŅŌĻĀ“ėŹ©æÉŅŌĢįøß
£¬²ÉČ”ŅŌĻĀ“ėŹ©æÉŅŌĢįøß![]() ²śĀŹµÄŹĒ______”£
²śĀŹµÄŹĒ______”£
A.½µµĶĢåĻµµÄĪĀ¶Č
B.Ń¹ĖõČŻĘ÷µÄĢå»ż
C.Ōö¼ÓCaOµÄĮæ
D.Ń”ÓĆŹŹµ±µÄ“߻ƼĮ
(4)ŅŌ¼×“¼ĪŖČ¼ĮĻ£¬![]() ĪŖŃõ»Æ¼Į£¬KOHČÜŅŗĪŖµē½āÖŹČÜŅŗ£¬æÉÖĘ³ÉČ¼ĮĻµē³Ų
ĪŖŃõ»Æ¼Į£¬KOHČÜŅŗĪŖµē½āÖŹČÜŅŗ£¬æÉÖĘ³ÉČ¼ĮĻµē³Ų![]() µē¼«²ÄĮĻĪŖ¶čŠŌµē¼«
µē¼«²ÄĮĻĪŖ¶čŠŌµē¼«![]() ”£ČōKOHČÜŅŗ×ćĮ棬Š“³ö“ĖČ¼ĮĻµē³Ųøŗ¼«µÄµē¼«·“Ó¦Ź½£ŗ______£»
”£ČōKOHČÜŅŗ×ćĮ棬Š“³ö“ĖČ¼ĮĻµē³Ųøŗ¼«µÄµē¼«·“Ó¦Ź½£ŗ______£»
(5)ČōĶł20mL![]() µÄČõĖį
µÄČõĖį![]() ČÜŅŗÖŠÖšµĪ¼ÓČėŅ»¶ØÅØ¶ČµÄÉÕ¼īČÜŅŗ£¬²āµĆ»ģŗĻČÜŅŗµÄĪĀ¶Č±ä»ÆČēĶ¼ĖłŹ¾£¬ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ______
ČÜŅŗÖŠÖšµĪ¼ÓČėŅ»¶ØÅØ¶ČµÄÉÕ¼īČÜŅŗ£¬²āµĆ»ģŗĻČÜŅŗµÄĪĀ¶Č±ä»ÆČēĶ¼ĖłŹ¾£¬ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ______
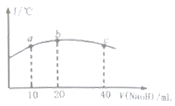
¢ŁøĆÉÕ¼īČÜŅŗµÄÅضČĪŖ![]()
¢ŚøĆÉÕ¼īČÜŅŗµÄÅضČĪŖ![]()
¢Ū![]() µÄµēĄėĘ½ŗā³£Źż£ŗbµć
µÄµēĄėĘ½ŗā³£Źż£ŗbµć![]() µć
µć
¢Ü“Óbµćµ½cµć£¬»ģŗĻČÜŅŗÖŠŅ»Ö±“ęŌŚ£ŗc(Na+)>c(NO2-)>c(OH-)>c(H+)
”¾“š°ø”æ![]() B
B ![]()
![]() A
A ![]() ¢Ś¢Ū
¢Ś¢Ū
”¾½āĪö”æ
£Ø1£©¢Łøł¾ŻĶ¼ĻńÖŠŹż¾ŻŗĶ»Æѧ·“Ó¦ĖŁĀŹµÄ¹«Ź½¼ĘĖć£»
¢Ś½įŗĻĶ¼ĻńŗĶÓŠ¹ŲŹż¾Ż¹ŲĻµ½ųŠŠ¼ĘĖć£¬øł¾Ż»ÆŃ§Ę½ŗāדĢ¬µÄ±źÖ¾·ÖĪöÅŠ¶Ļ£»
£Ø2£©øł¾ŻČż¶ĪŹ½½ųŠŠ¼ĘĖć£»
£Ø3£©¢Łøł¾ŻøĒĖ¹¶ØĀɽųŠŠ¼ĘĖć£»
¢Śøł¾ŻÓ°Ļģ»ÆŃ§Ę½ŗāŅĘ¶ÆµÄŅņĖŲ·ÖĪöÅŠ¶Ļ£»
£Ø4£©CH3OHŌŚøŗ¼«·¢ÉśŹ§µē×ÓµÄŃõ»Æ·“Ó¦£¬¾Ż“ĖŹéŠ“µē¼«·“Ó¦Ź½£»
£Ø5£©bµćĪĀ¶Č×īøߣ¬ĖµĆ÷“ĖŹ±NaOHÓėNaNO2Ē”ŗĆĶźČ«·“Ó¦£¬¾Ż“Ė·ÖĪöÅŠ¶Ļ”£
£Ø1£©¢Łøł¾ŻĶ¼Ļń£¬¦Ō£ØCO£©=![]() mol/(L”¤min)=0.3 mol/(L”¤min)£»
mol/(L”¤min)=0.3 mol/(L”¤min)£»
¢ŚA.µ½“ļĘ½ŗāŹ±£¬ĻūŗÄĒāĘųµÄĪļÖŹµÄĮæÅضČĪŖ2”Į(2£0.5)mol”¤L£1=3mol”¤L£1£¬ĒāĘųµÄ×Ŗ»ÆĀŹĪŖ![]() ”Į100%=75%£¬Ń”ĻīA“ķĪó£»
”Į100%=75%£¬Ń”ĻīA“ķĪó£»
B.»ģŗĻĘųĢåµÄÖŹĮæŹ¼ÖÕ²»±ä£¬µ«øĆ·“Ó¦ŹĒĘųĢåĪļÖŹµÄĮæ¼õÉŁµÄ·“Ó¦£¬Ņņ“Ė»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»±äŹ±£¬ĖµĆ÷“ļµ½Ę½ŗā£¬ŌŚ5minŹ±£¬·“Ó¦“ļµ½Ę½ŗā£¬Ń”ĻīBÕżČ·£»
C.ŗćȯדĢ¬ĻĀ£¬³äČėNH3£¬ø÷×é·ÖÅØ¶Č²»±ä£¬»Æѧ·“Ó¦ĖŁĀŹ²»±ä£¬Ń”ĻīC“ķĪó£»
D.5minŹ±·“Ó¦“ļµ½Ę½ŗā£¬5minĒ°¶¼ĪŖ¦Ō( Õż)>¦Ō(Äę)£¬Ń”ĻīD“ķĪó£»
“š°øŃ”B£»
£Ø2£©ŅņĪŖøĆ·“Ó¦·“Ó¦Ē°ŗóĘųĢå·Ö×ÓŹż²»±ä£¬ŌņĮīNO2µÄĪļÖŹµÄĮæÅضČĪŖ1mol/L£¬SO2µÄĪļÖŹµÄĮæĪŖ2mol/L£¬
øł¾ŻĢāŅāµĆ³ö![]() ”Į100%=25%£¬½āµĆx=0.75£¬øł¾Ż»ÆŃ§Ę½ŗā³£ŹżµÄ¶ØŅ壬
”Į100%=25%£¬½āµĆx=0.75£¬øł¾Ż»ÆŃ§Ę½ŗā³£ŹżµÄ¶ØŅ壬![]() £¬Ņņ“ĖÓŠK=
£¬Ņņ“ĖÓŠK=![]() =1.8£»
=1.8£»
£Ø3£©¢Łøł¾ŻøĒĖ¹¶ØĀÉ£¬ÓÉI+II£«IIIµĆ³ö”÷H=(131£43£178.3)kJ”¤mol£1=£90.3kJ”¤mol£1£»
¢ŚA.Õż·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬½µµĶĪĀ¶Č£¬Ę½ŗāĻņÕż·“Ó¦·½Ļņ½ųŠŠ£¬ĒāĘųµÄ²śĀŹŌö¼Ó£¬Ń”ĻīAæɲÉČ”£»
B.·“Ó¦Ē°ŗóĘųĢåĻµŹżÖ®ŗĶĻąµČ£¬Ń¹ĖõČŻĘ÷µÄĢå»ż£¬Ę½ŗā²»ŅĘ¶Æ£¬¼“H2µÄ²śĀŹ²»±ä£¬Ń”ĻīB²»æɲÉČ”£»
C.CaOŹĒ¹ĢĢ壬ÅØ¶ČŹÓĪŖ³£Źż£¬¼“Ōö¼ÓCaOĮæ£¬Ę½ŗā²»ŅĘ¶Æ£¬H2µÄ²śĀŹ²»±ä£¬Ń”ĻīC²»æɲÉČ”£»
D.“߻ƼĮ¶ŌĘ½ŗāµÄŅʶÆĪŽÓ°Ļģ£¬H2µÄ²śĀŹ²»±ä£¬Ń”ĻīD²»æɲÉČ”£»
“š°øŃ”A£»
£Ø4£©ŅŌ¼×“¼ĪŖČ¼ĮĻ£¬![]() ĪŖŃõ»Æ¼Į£¬KOHČÜŅŗĪŖµē½āÖŹČÜŅŗ£¬Ķؼד¼Ņ»¼«ĪŖøŗ¼«£¬øŗ¼«µē¼«·“Ó¦Ź½ĪŖ
ĪŖŃõ»Æ¼Į£¬KOHČÜŅŗĪŖµē½āÖŹČÜŅŗ£¬Ķؼד¼Ņ»¼«ĪŖøŗ¼«£¬øŗ¼«µē¼«·“Ó¦Ź½ĪŖ![]() £»
£»
£Ø5£©¢Ł¢Śµ±¼ÓČė20mLĒāŃõ»ÆÄĘČÜŅŗŹ±£¬ĪĀ¶Č“ļµ½×īøߣ¬Į½ÕßĒ”ŗĆĶźČ«·“Ó¦£¬ŌņNaOHµÄÅضČĪŖ0.01mol”¤L-1£¬¢Ł“ķĪ󔢢ŚÕżČ·£»¢ŪµēĄėĘ½ŗā³£ŹżŹÜĪĀ¶ČµÄÓ°Ļģ£¬Čõµē½āÖŹµÄµēĄėŹĒĪüČČ¹ż³Ģ£¬ÉżøßĪĀ¶Č“Ł½ųµēĄė£¬bµćĪĀ¶Č±Čaµćøߣ¬Ņņ“ĖbµćHNO2µÄµēĄėĘ½ŗā³£Źż±Čaµć“󣬢ŪÕżČ·£»¢Ü“Óbµćµ½cµć£¬ŌŚcµćČÜŅŗÖŠČÜÖŹĪŖNaNO2ŗĶNaOH£¬ĒŅĮ½ÕßĪļÖŹµÄĮæĻąµČ£¬“ĖŹ±µÄĄė×ÓÅØ¶Č“óŠ”Ė³ŠņŹĒ£ŗc(Na£«)>c(OH£)>c(NO2£)>c(H£«)£¬¢Ü“ķĪó£»
“š°øŃ”¢Ś¢Ū”£


 ŠĀĖ¼Ī¬¼ŁĘŚ×÷Ņµŗ®¼Ł¼ŖĮÖ“óѧ³ö°ęÉēĻµĮŠ“š°ø
ŠĀĖ¼Ī¬¼ŁĘŚ×÷Ņµŗ®¼Ł¼ŖĮÖ“óѧ³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚ10 LŗćČŻĆܱÕČŻĘ÷ÖŠ³äČėX(g)ŗĶY(g)£¬·¢Éś·“Ó¦X(g)£«Y(g) ![]() M(g)£«N(g)£¬ĖłµĆŹµŃ鏿¾ŻČēĻĀ±ķ£ŗ
M(g)£«N(g)£¬ĖłµĆŹµŃ鏿¾ŻČēĻĀ±ķ£ŗ
ŹµŃé ±ąŗÅ | ĪĀ¶Č/”ę | ĘšŹ¼Ź±ĪļÖŹµÄĮæ/mol | Ę½ŗāŹ±ĪļÖŹµÄĮæ/mol | ||
n(X) | n(Y) | n(M) | |||
¢Ł | 700 | 0.40 | 0.10 | 0.090 | |
¢Ś | 800 | 0.10 | 0.40 | 0.080 | |
¢Ū | 800 | 0.20 | 0.30 | a | |
¢Ü | 900 | 0.10 | 0.15 | b | |
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ(””””)
A. ŹµŃé¢ŁÖŠ£¬Čō5 minŹ±²āµĆn(M)£½0.050 mol£¬Ōņ0ÖĮ5 minŹ±¼äÄŚ£¬ÓĆN±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹv(N)£½1.0”Į10£2 mol”¤L£1”¤min£1
B. ŹµŃé¢ŚÖŠ£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżK£½2.0
C. ŹµŃé¢ŪÖŠ£¬“ļµ½Ę½ŗāŹ±£¬XµÄ×Ŗ»ÆĀŹĪŖ60%
D. ŹµŃé¢ÜÖŠ£¬“ļµ½Ę½ŗāŹ±£¬b>0.060
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻÖŠčÉč¼ĘŅ»Ģ׏µŃé×°ÖĆĄ“µē½ā±„ŗĶŹ³ŃĪĖ®£¬²¢²āĮæµē½ā²śÉśµÄĒāĘųµÄĢå»ż(Ō¼6 mL)ŗĶ¼ģŃéĀČĘųµÄŃõ»ÆŠŌ(²»Ó¦½«¶ąÓąµÄĀČĘųÅÅČėæÕĘųÖŠ)”£
£Ø1£©ŹŌ“ÓÉĻĶ¼Ķ¼1ÖŠŃ”ÓĆ¼øÖÖ±ŲŅŖµÄŅĒĘ÷,Į¬³ÉŅ»ÕūĢ××°ÖĆ,ø÷ÖÖŅĒĘ÷½ÓæŚµÄĮ¬½ÓĖ³Šņ(Ģī±ąŗÅ)ŹĒ:A½Ó________,B½Ó________”£
£Ø2£©Ģś°ō½ÓÖ±Į÷µēŌ“µÄ________¼«;Ģ¼°ōÉĻ·¢ÉśµÄµē¼«·“Ó¦ĪŖ________”£
£Ø3£©ÄÜĖµĆ÷ĀČĘų¾ßÓŠŃõ»ÆŠŌµÄŹµŃéĻÖĻóŹĒ________”£
£Ø4£©¼Ł¶Ø×°ČėµÄ±„ŗĶŹ³ŃĪĖ®ĪŖ50 mL(µē½āĒ°ŗóČÜŅŗĢå»ż±ä»ÆæÉŗöĀŌ),µ±²āµĆµÄĒāĘųĪŖ5.6 mL£ØŅŃÕŪĖć³É±ź×¼×“æö£©Ź±,ČÜŅŗµÄpHĪŖ________”£
£Ø5£©¹¤ŅµÉĻ²ÉÓĆĄė×Ó½»»»Ä¤·Øµē½ā±„ŗĶŹ³ŃĪĖ®£¬ČēÉĻĶ¼Ķ¼2£¬øĆĄė×Ó½»»»Ä¤ŹĒ________£ØĢī”°ŃōĄė×Ó”±»ņ”°ŅõĄė×Ó”±£©½»»»Ä¤£¬ČÜŅŗAŹĒ________£ØĢīČÜÖŹµÄ»ÆѧŹ½£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖµēµ¼ĀŹŌ½“óµ¼µēÄÜĮ¦Ō½Ē攣³£ĪĀĻĀÓĆ0.100 mol”¤L-1NaOHČÜŅŗ·Ö±šµĪ¶Ø10.00mLÅØ¶Č¾łĪŖ0.100 mol”¤L-1µÄŃĪĖįŗĶ“×ĖįČÜŅŗ£¬²āµĆµĪ¶Ø¹ż³ĢÖŠČÜŅŗµÄµēµ¼ĀŹČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

A. ĒśĻߢŁ“ś±ķµĪ¶ØŃĪĖįµÄĒśĻß
B. µĪ¶Ø“×ĖįµÄ¹ż³ĢÓ¦øĆŃ”Ōń¼×»ł³Č×÷ĪŖÖøŹ¾¼Į
C. a”¢b”¢cČżµćČÜŅŗÖŠĖ®µÄµēĄė³Ģ¶Č£ŗc>a>b
D. bµćČÜŅŗÖŠ£ŗc(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬0.2mol/LŅ»ŌŖĖįHAÓėµČÅØ¶ČµÄNaOHČÜŅŗµČĢå»ż»ģŗĻŗó£¬ĖłµĆČÜŅŗÖŠ²æ·ÖĪ¢Į£×é·Ö¼°ÅضČČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

A. HAŹĒĒæĖį
B. øĆ»ģŗĻŅŗpH=7
C. Ķ¼ÖŠx±ķŹ¾HA£¬Y±ķŹ¾OH-£¬Z±ķŹ¾H+
D. øĆ»ģŗĻČÜŅŗÖŠ£ŗc(A-)+c(Y)=c£ØNa+£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æNaOHČÜŅŗæÉÓĆÓŚ¶ąÖÖĘųĢåµÄ“¦Ąķ£®
(1)CO2ŹĒĪĀŹŅĘųĢ壬æÉÓĆNaOHČÜŅŗĪüŹÕµĆµ½Na2CO3»ņNaHCO3£®
¢ŁNa2CO3Ė×³Ę“æ¼ī£¬ŅņCO32©Ė®½ā¶ųŹ¹ĘäĖ®ČÜŅŗ³Ź¼īŠŌ£¬Š“³öCO32©µŚŅ»²½Ė®½āµÄĄė×Ó·½³ĢŹ½_________£®ŅŃÖŖ25”ꏱ£¬CO32©µŚŅ»²½Ė®½āµÄĘ½ŗā³£ŹżKh=2”Į10©4mol/L£¬µ±ČÜŅŗÖŠc£ØHCO3©£©£ŗc£ØCO32©£©=20£ŗ1 Ź±£¬ČÜŅŗµÄpH=_____£®
¢ŚÅŻÄĆš»šĘ÷ÖŠĶس£×°ÓŠNaHCO3 ČÜŅŗŗĶAl2(SO4)3ČÜŅŗ£¬ĒėŠ“³öÕāĮ½ÖÖČÜŅŗ»ģŗĻŹ±µÄĄė×Ó·“Ó¦·½³ĢŹ½__________£®
(2)½šŹōÓėÅØĻõĖį·“Ó¦²śÉśµÄNO2æÉÓĆNaOHČÜŅŗĪüŹÕ£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ2NO2+2NaOH=NaNO3+NaNO2+H2O£®ŗ¬0.2molNaOHµÄĖ®ČÜŅŗÓė0.2mol NO2Ē”ŗĆĶźČ«·“Ó¦µĆ1LČÜŅŗA£¬ČÜŅŗBĪŖ0£®lmolL©1CH3COONaČÜŅŗ£¬ŌņĮ½·ŻČÜŅŗÖŠc£ØNO3©£©”¢c£ØNO2©£©ŗĶc£ØCH3COO©£©Óɓ󵽊”µÄĖ³ŠņĪŖ___________£ØŅŃÖŖHNO2µÄµēĄė³£ŹżKa=7.1”Į10©4molL©1£¬CH3COOHµÄµēĄė³£ŹżKa=1.7”Į10©5molL©1£©£®æÉŹ¹ČÜŅŗAŗĶČÜŅŗBµÄ pHĻąµČµÄ·½·ØŹĒ_____£®
A£®ĻņČÜŅŗAÖŠ¼ÓŹŹĮæNaOH B£®ĻņČÜŅŗAÖŠ¼ÓŹŹĮæĖ®
C£®ĻņČÜŅŗBÖŠ¼ÓŹŹĮæNaOH D£®ĻņČÜŅŗBÖŠ¼ÓŹŹĮæĖ®
(3)ŃĢĘųÖŠµÄSO2»įŅżĘšĖįÓź£¬æÉĄūÓĆĒāŃõ»ÆÄĘČÜŅŗĪüŹÕ”£ĪüŹÕSO2µÄ¹żńĪÖŠ£¬ČÜŅŗÖŠH2SO3”¢HSO3©”¢SO32©ČżÕßĖłÕ¼ĪļÖŹµÄĮæ·ÖŹż£Øa£©ĖępH±ä»ÆµÄ¹ŲĻµČēĶ¼ĖłŹ¾£ŗ

¢ŁĶ¼ÖŠpH=7Ź±£¬ČÜŅŗÖŠĄė×ÓÅØ¶Č¹ŲĻµÕżČ·µÄŹĒ___”£
A£®c£ØNa+£©£¾2c£ØSO32©£©£¾c£ØHSO3©£©
B£®c£ØNa+£©=c£ØSO32©£©+c£ØHSO3©£©+c£ØH2SO3£©
C£®c£ØOH©£©=c£ØH+£©+c£ØH2SO3£©+c£ØHSO3©£©
D£®c£ØNa+£©£¾c£ØHSO3©£©£¾c£ØSO32©£©£¾c£ØH+£©=c£ØOH©£©
¢ŚĄūÓĆÉĻĶ¼ÖŠŹż¾Ż£¬Ēó·“Ó¦H2SO3![]() H++ HSO3©µÄĘ½ŗā³£ŹżµÄŹżÖµ____£®
H++ HSO3©µÄĘ½ŗā³£ŹżµÄŹżÖµ____£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¾ųČČČŻĘ÷ÖŠ·¢Éś·“Ó¦£ŗ3Z£Øs£©![]() X£Øg£©£«2Y£Øg£©”÷H£½a kJ”¤mol£1£Øa£¾0£©”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
X£Øg£©£«2Y£Øg£©”÷H£½a kJ”¤mol£1£Øa£¾0£©”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A.½«0.3 mol ZÖĆÓŚČŻĘ÷ÖŠ³ä·Ö·“Ӧɜ³ÉĘųĢåµÄĪļÖŹµÄĮæŅ»¶ØŠ”ÓŚ0.3 mol
B.“ļµ½»ÆŃ§Ę½ŗāדĢ¬Ź±£¬ĘųĢåĘ½¾łÄ¦¶ūÖŹĮæ²»±ä
C.ČŻĘ÷ÖŠ·ÅČė3mol Z£¬“ļµ½»ÆŃ§Ę½ŗāדĢ¬Ź±£¬·“Ó¦ĪüŹÕµÄ×ÜČČĮæĪŖa kJ
D.ČŻĘ÷ĪĀ¶Č²»±ä£¬·“Ó¦ŅŃ¾“ļµ½Ę½ŗā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫Ņ»¶ØĮæ“æ¾»µÄ°±»ł¼×Ėįļ§ÖĆÓŚĢŲÖʵÄĆܱÕÕęæÕČŻĘ÷ÖŠ![]() ¼ŁÉčČŻĘ÷Ģå»ż²»±ä£¬¹ĢĢåŹŌŃłĢå»żŗöĀŌ²»¼Ę
¼ŁÉčČŻĘ÷Ģå»ż²»±ä£¬¹ĢĢåŹŌŃłĢå»żŗöĀŌ²»¼Ę![]() £¬Ź¹Ęä“ļµ½·Ö½āĘ½ŗā£ŗ
£¬Ź¹Ęä“ļµ½·Ö½āĘ½ŗā£ŗ![]() ”£ŹµŃé²āµĆ²»Ķ¬ĪĀ¶ČĻĀµÄĘ½ŗāŹż¾ŻĮŠÓŚĻĀ±ķ£ŗ
”£ŹµŃé²āµĆ²»Ķ¬ĪĀ¶ČĻĀµÄĘ½ŗāŹż¾ŻĮŠÓŚĻĀ±ķ£ŗ
ĪĀ¶Č |
|
|
|
|
|
Ę½ŗāĘųĢå×ÜÅØ¶Č |
|
|
|
|
|
ĻĀĮŠÓŠ¹ŲŠšŹöÕżČ·µÄŹĒ
A.øĆæÉÄę·“Ó¦“ļµ½Ę½ŗāµÄ±źÖ¾Ö®Ņ»ŹĒ»ģŗĻĘųĢåĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»±ä
B.ŅņøĆ·“Ó¦![]() ”¢
”¢![]() £¬ĖłŅŌŌŚµĶĪĀĻĀ×Ō·¢½ųŠŠ
£¬ĖłŅŌŌŚµĶĪĀĻĀ×Ō·¢½ųŠŠ
C.“ļµ½Ę½ŗāŗó£¬ČōŌŚŗćĪĀĻĀŃ¹ĖõČŻĘ÷Ģå»ż£¬ĢåĻµÖŠĘųĢåµÄÅضČŌö“ó
D.øł¾Ż±ķÖŠŹż¾Ż£¬¼ĘĖć![]() Ź±µÄ·Ö½āĘ½ŗā³£ŹżŌ¼ĪŖ
Ź±µÄ·Ö½āĘ½ŗā³£ŹżŌ¼ĪŖ![]()
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĶ¼Ź¾Óė¶ŌÓ¦µÄŠšŹöĻą·ūµÄŹĒ
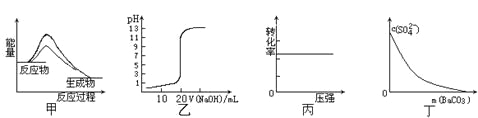
A.Ķ¼¼×±ķŹ¾Ź¹ÓĆ“ß»Æ¼Įŗó£¬øĆ·“Ó¦µÄ¦¤H±äŠ”
B.Ķ¼ŅŅ±ķŹ¾0£®10mol”¤L-1NaOHČÜŅŗµĪ¶Ø20£®00mL0£®10mol”¤L-1CH3COOHČÜŅŗĖłµĆµ½µÄµĪ¶ØĒśĻß
C.Ķ¼±ū±ķŹ¾·“Ó¦H2(g) + I2(g)![]() 2HI(g)ÖŠH2µÄ×Ŗ»ÆĀŹĖęŃ¹ĒæµÄ±ä»Æ
2HI(g)ÖŠH2µÄ×Ŗ»ÆĀŹĖęŃ¹ĒæµÄ±ä»Æ
D.Ķ¼¶”±ķŹ¾ŌŚ±„ŗĶNa2SO4ČÜŅŗÖŠÖš²½¼ÓBaCO3¹ĢĢåŗó£¬ČÜŅŗÖŠc(SO42-)µÄÅØ¶Č±ä»Æ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com