
| A. | 溶液中Cu2+浓度增大 | B. | 溶液中Cu2+数目增大 | ||
| C. | 该硫酸铜晶体体积不变 | D. | 溶液的蓝色不变 |
分析 在饱和硫酸铜溶液中加入无水硫酸铜粉末,发生:CuSO4+xH2O=CuSO4•xH2O,导致溶液中水的量减少,会导致平衡:Cu2++SO42-+xH2O?CuSO4•xH2O向正方向移动,则析出晶体后溶液仍为饱和溶液,溶液浓度不变,但是溶液中铜离子数目减少,以此解答该题.
解答 解:在饱和硫酸铜溶液中加入无水硫酸铜粉末,发生:CuSO4+xH2O=CuSO4•xH2O,导致溶液中水的量减少,会导致平衡:
Cu2++SO42-+xH2O?CuSO4•xH2O向正方向移动,则析出晶体后溶液仍为饱和溶液,
A.由于溶液仍为饱和溶液,则溶液中Cu2+浓度不变,故A错误;
B.由于Cu2++SO42-+xH2O?CuSO4•xH2O向正方向移动,溶液中Cu2+数目减少,故B错误;
C.Cu2++SO42-+xH2O?CuSO4•xH2O向正方向移动,析出晶体,硫酸铜晶体体积增大,故C错误;
D.溶液中铜离子浓度不变,则溶液颜色不变,故D正确;故选D.
点评 本题考查饱和溶液的知识,题目难度不大,注意加入硫酸铜固体后溶液中溶剂的质量减少,析出更多的晶体,析出后仍为饱和溶液,理解该点为解答该题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | pH<7的溶液中:Al3+、K+、SO32-、Cl- | |
| B. | 加入铝粉能放出氢气的溶液中:CO32-、AlO2-、I-、NO3- | |
| C. | 能使pH试纸变深蓝色的溶液中:S2-、SO32-、S2O32-、SO42- | |
| D. | 由水电离出的[OH-]=1×10-13mol/L的溶液中:Fe2+、NH4+、ClO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在镀件上电镀铜时,可用金属铜作阳极 | |
| B. | 镀层破损后,白铁(镀锌)比马口铁(镀锡)更易被腐蚀 | |
| C. | 工业上电解饱和食盐水制烧碱,用阳离子交换膜阻止OH-移向阳极 | |
| D. | 钢铁在发生析氢腐蚀和吸氧腐蚀时,完全相同的反应是负极反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 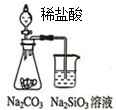 如图可能证明非金属性强弱:Cl>C>Si | |
| B. | 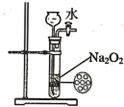 如图装置可用来制备少量氧气,并且控制反应的发生与停止 | |
| C. | 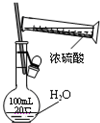 图中配制一定物质的量浓度的硫酸溶液不能直接在容量瓶中进行 | |
| D. | 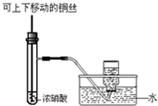 如图为制备并收集少量NO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸中逐滴加入食盐溶液 | B. | 硫酸中逐滴加入氢氧化钠溶液 | ||
| C. | 石灰乳中滴加稀盐酸 | D. | 硫酸中逐滴加入氢氧化钡溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
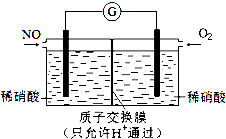 NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义.
NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com