
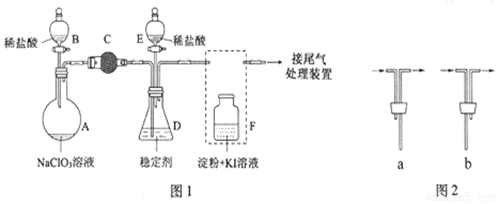
分析 (1)根据仪器特征,可知仪器C是球形干燥管;F装置应是Cl2和KI反应,还需要连接尾气处理装置,所以应长管进气,短管出气;
(2)根据电子转移守恒和原子守恒书写氯酸钠和稀盐酸混和产生Cl2和ClO2的反应化学方程式;
(3)为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢;
(4)F装置中发生Cl2+2KI=2KCl+I2时,碘遇淀粉变蓝,而F中溶液的颜色不变,说明Cl2被吸收;
(5)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,该反应的离子方程式为4H++5ClO2-=Cl-+4ClO2↑+2H2O; 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成;考虑到气体要与溶液充分接触且尾气易排出,应选择长进短出的装置;
解答 解:(1)根据仪器特征,可知仪器C是球形干燥管;F装置应是Cl2和KI反应,还需要连接尾气处理装置,所以应长管进气,短管出气,故选b,
故答案为:分液漏斗;锥形瓶;
(2)氯酸钠和稀盐酸混和产生Cl2和ClO2,NaClO3中氯为+5价被还原成ClO2中+4价,盐酸中氯为-1价,被氧化成0价氯,转移电子数为2,所以NaClO3、ClO2前系数为2,Cl2前系数为1,反应化学方程式:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O,故答案为:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O;
(3)为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢,故滴加稀盐酸的速度要慢,即调节分液漏斗B的旋塞,减缓(慢)稀盐酸滴加速度,
故答案为:慢;
(4)F装置中发生Cl2+2KI=2KCl+I2时,碘遇淀粉变蓝,而F中溶液的颜色不变,则装置C的作用是吸收Cl2,
故答案为:吸收Cl2;
(5)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,该反应的离子方程式为:4H++5ClO2-=Cl-+4ClO2↑+2H2O; 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成,为确保气体顺利流通,应选择b装置;
故答案为:4H++5ClO2-=Cl-+4ClO2↑+2H2O;检验是否有ClO2生成;b.
点评 本题以ClO2的制备、吸收、释放为载体,考查实验制备方案设计、基本操作、对装置及操作的分析评价等,注意根据问题进行制备流程分析,难度中等.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:解答题
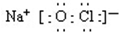 ;若将84消毒液长期露置于空气中,溶液中的主要成分最终将变为NaCl.(填化学式)
;若将84消毒液长期露置于空气中,溶液中的主要成分最终将变为NaCl.(填化学式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃容器可长期盛放各种酸 | |
| B. | 水中加入明矾、硫酸铁溶液可以起净水作用 | |
| C. | Al2O3可制造耐高温的实验仪器 | |
| D. | Na2S可除去污水中有毒的Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2 | B. | Ca(ClO)2 | C. | Ca(OH)2 | D. | HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝粉能产生H2的溶液:Fe2+、NH4+、SO42-、NO3- | |
| B. | 室温下水电离出c(H+)=1×10-13 mol/L的溶液:HCO3-、K+、SO42-、Cl- | |
| C. | 使酚酞变红色的溶液:Na+、K+、AlO2-、CO32- | |
| D. | 含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘升华 | B. | 盐酸和氢氧化钠溶液混合 | ||
| C. | 氯化氢溶于水 | D. | 氯化氢与氨气反应生成氯化铵固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅可用作半导体材料 | |
| B. | 甲醛可用作食品防腐剂 | |
| C. | 氧化铝熔点高,常用于制造耐火材料 | |
| D. | 高压钠灯发出黄光,透雾能力强,常用于道路和广场照明 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com