
| A. | 氧化还原反应中的反应物,不是氧化剂就是还原剂 | |
| B. | 在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数 | |
| C. | 能导电的物质一定是电解质 | |
| D. | 金属氧化物一定是碱性氧化物 |
分析 A.氧化还原反应中的反应物,可能不是氧化剂,也不是还原剂;
B.氧化还原反应中,氧化剂、还原剂之间得失电子数目相等;
C.存在自由移动离子或自由电子的物质能导电;
D.金属氧化物也可能是酸性氧化物或两性氧化物.
解答 解:A.氧化还原反应中的反应物,可能不是氧化剂,也不是还原剂,如氯气与NaOH的反应中,NaOH为反应物,不是氧化剂也不是还原剂,故A错误;
B.氧化还原反应中,氧化剂中元素的化合价降低得电子,还原剂中元素的化合价升高失电子,氧化剂、还原剂之间得失电子数目相等,故B正确;
C.存在自由移动离子或自由电子的物质能导电,电解质固体时不能电离不导电,金属单质能导电不是电解质,故C错误;
D.金属氧化物也可能是酸性氧化物或两性氧化物,如Mn2O7属于酸性氧化物,Al2O3属于两性氧化物,它们都是金属氧化物,故D错误.
故选B.
点评 本题考查氧化还原反应、电解质、物质的分类,把握反应中元素的化合价变化以及物质的分类方法为解答的关键,侧重氧化还原反应基本概念及实例的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0-10min内,用A表示的平均反应速率是0.05mol•L-1•min-1 | |
| B. | 0-10min内,用B表示的平均反应速率是0.01mol•L-1•min-1 | |
| C. | 分别用B、C、D表示反应的速率,其比值是4:3:1 | |
| D. | 随着反应的进行,容器内气体压强始终保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期主族元素,原子半径随原子序数增大而增大 | |
| B. | 第3周期主族元素的最高正化合价等于它所处的主族序数 | |
| C. | 周期表中所含元素种类最多的族是ⅠA族 | |
| D. | 稀有气体元素原子的最外层电子数均为8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2 | B. | CH3CH=CH2 | C. | CH3CH3 | D. | CH3CH2CH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
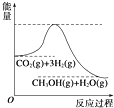 (1)盖斯定律的含义是:对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是相同的,换句话说:化学反应的反应热只与体系的始态和终态有关,而与反应的途径无关
(1)盖斯定律的含义是:对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是相同的,换句话说:化学反应的反应热只与体系的始态和终态有关,而与反应的途径无关查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com