
 在一密闭容器中发生反应N2+3H2?2NH3,正反应为放热反应,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示
在一密闭容器中发生反应N2+3H2?2NH3,正反应为放热反应,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示分析 (1)根据图示结合v正=v逆,判断是否处于平衡状态;
(2)由图可知,t1正逆反应速率均增大,且逆反应速率大于正反应速率;t3正逆反应速率同等程度的增大;t4时正逆反应速率均减小,且逆反应速率大于正反应速率;
(3)由图可知,t1平衡逆向移动,t3不移动,t4平衡逆向移动,根据移动结果分析;
(4)t6时刻分离出部分NH3,v逆立刻减小,而v正逐渐减小,在t7时刻二者相等,反应重新达平衡,据此可画出反应速率的变化曲线;
(5)设反应前加入a mol N2,b mol H2,达平衡时生成2x mol NH3,根据三段式和氨气的体积分数计算.
解答 解:(1)根据图示可知,t0~t1、t2~t3、t3~t4、t5~t6时间段内,v正、v逆相等,反应处于平衡状态,
故答案为:ACDF;
(2)由N2(g)+3H2(g)?2NH3(g)△H<0,可知,该反应为放热反应,且为气体体积减小的反应,则由图可知,t1正逆反应速率均增大,且逆反应速率大于正反应速率,改变条件应为升高温度;
t3正逆反应速率同等程度的增大,改变条件应为使用催化剂;
t4时正逆反应速率均减小,且逆反应速率大于正反应速率,改变条件应为减小压强,
故答案为:C;E;B;
(3)由图可知,t1平衡逆向移动,t3不移动,t4平衡逆向移动,均使氨气的含量减少,则t0~t1氨气的含量最大,
故答案为:A;
(4)t6时刻分离出部分NH3,v逆立刻减小,而v正逐渐减小,在t7时刻二者相等,反应重新达平衡,据此可画出反应速率的变化曲线为: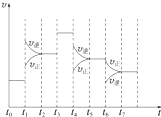 ,
,
故答案为: ;
;
(5)设反应前加入a mol N2,b mol H2,达平衡时生成2x mol NH3,
N2(g)+3H2(g)?2NH3(g)
起始 a b 0
转化 x 3x 2x
平衡 a-x b-3x 2x
则反应后气体总的物质的量=(a+b-2x)mol,$\frac{2x}{a+b-2x}$=0.2,解得:a+b=12x,故反应后与反应前的混合气体体积之比=$\frac{a+b-2x}{a+b}$=$\frac{12x-2x}{12x}$=$\frac{5}{6}$,
故答案为:5:6.
点评 本题考查影响化学反应速率的因素,注意把握反应的特点及图象分析是解答的关键,明确温度、压强、催化剂对反应速率的影响即可解答,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C=O | C-O | O-H | C-H |
| 键能(kJ/mol) | 436 | 728 | 326 | 464 | 414 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | C2H6 | C2H4 | C2H2 | C2H5OH | C3H8 |
| 燃烧热(kJ•mol-1) | -1560 | -1411 | -1230 | -1367 | -2220 |
| A. | 煤制乙醇,有利于保护环境和充分利用能源 | |
| B. | 煤制乙醇,使用合适的催化剂能提高反应选择性 | |
| C. | 汽油中添加一定量乙醇,汽油燃烧的更充分 | |
| D. | 等物质的量的乙醇、汽油(C5~C12的烃)完全燃烧,乙醇放出的热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成高分子的小分子就是高分子的链节 | |
| B. | 缩聚反应的产物只有高分子 | |
| C. | 聚乙烯具有热塑性 | |
| D. | 1mol 水解后只能与1molNaOH反应 水解后只能与1molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断中正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断中正确的是( )| A. | 单质的熔点:R<T<Q | B. | R与Q的电子数相差36 | ||
| C. | 形成气态氢化物的难易:R<T<Q | D. | 最高价氧化物的水化物的酸性:T>Q |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图所示,圆底烧瓶中充满干燥的氯气,将胶头滴管中的浓氨水挤入圆底烧瓶中,发生反应:2NH3+3Cl2═N2+6HCl,同时生成白烟并发红光.回答下列问题.
如图所示,圆底烧瓶中充满干燥的氯气,将胶头滴管中的浓氨水挤入圆底烧瓶中,发生反应:2NH3+3Cl2═N2+6HCl,同时生成白烟并发红光.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 单质的还原性:Y>X | |
| B. | 元素M与N能形成的共价化合物不止一种 | |
| C. | 通常状况下,元素Z的单质不能与元素M的氧化物反应 | |
| D. | 元素X、Y、Z的最高价氧化物对应的水化物彼此间均可发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com