
【题目】A+、B+、C-、D、E、F2- 6种微粒(分子或离子),它们分别含10个电子,其中只有B+和F2-为单核微粒,且C-和E的组成元素相同,已知它们有如下转化关系:A++C-![]() D+E,据此回答下列问题:
D+E,据此回答下列问题:
(1)写出D的结构式___________,E的结构式___________。
(2)实验室制备D物质的反应方程式________。
(3)上述六种微粒中所含有的元素原子半径从大到小的顺序是__(用元素符号表示)。
(4)B、F两元素组成的原子数目比为1:1的化合物的电子式___________、该物质中存在的化学键有__。
【答案】![]() H—O—H 2NH4Cl+Ca(OH)2
H—O—H 2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O Na>N>O>H
2NH3↑+CaCl2+2H2O Na>N>O>H ![]() 离子键 非极性共价键
离子键 非极性共价键
【解析】
10电子微粒有:H2O、NH3、CH4、HF、NH4+、H3O+、OH-、Al3+、Na+、Mg2+、O2-、F-等微粒,由B+和F2-为单核微粒可知,B+为Na+、F2-为O2-;有C-和E的组成元素相同可知,C-为OH-、E为H2O;由反应A++C-→D+E可知,A+为NH4+、D为NH3。
(1)D为NH3,结构式为![]() ;E为H2O,结构式为H—O—H,故答案为:
;E为H2O,结构式为H—O—H,故答案为:![]() ;H—O—H;
;H—O—H;
(2)实验室用氯化铵与消石灰共热制备氨气,反应的化学方程式为2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O,故答案为:2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O,故答案为:2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O;
2NH3↑+CaCl2+2H2O;
(3)Na在短周期元素中原子半径最大,H在周期表中原子半径最小,N和O位于同一周期,同一周期元素,从左到右原子半径依次减小,则原子半径从大到小的顺序是Na>N>O>H,故答案为:Na>N>O>H;
(5)B、F两元素组成的原子数目比为1:1的化合物为离子化合物Na2O2,电子式为![]() ,Na2O2中存在的化学键有离子键和非极性共价键,故答案为:
,Na2O2中存在的化学键有离子键和非极性共价键,故答案为:![]() ;离子键 非极性共价键。
;离子键 非极性共价键。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl—,降低对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq)![]() CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl—)的影响如图所示。下列说法正确的是

A. 溶液pH越大,Ksp(CuCl)增大
B. 向电解液中加入稀硫酸,有利于Cl-的去除
C. 反应达到平衡增大c(Cu2+),c(Cl—)减小
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl—(aq)
Cu2+(aq)+Cl—(aq)![]() CuCl(s)的ΔH=(a+2b) kJ·mol-1
CuCl(s)的ΔH=(a+2b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物的应用范围很广。下列说法正确的是
A.硅是人类将太阳能转换为电能的常用材料
B.粗硅制备单晶硅不涉及氧化还原反应
C.反应Si+2NaOH+H2O=Na2SiO3+2H2↑中,Si为氧化剂
D.硅能与氢氟酸反应,则硅可以与盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同条件下分别测得反应2SO2+O2![]() 2SO3的化学反应速率,其中表示该反应进行最快的是( )
2SO3的化学反应速率,其中表示该反应进行最快的是( )
A. v(SO2)=4 mol·L-1·min-1B. v (O2)=3 mol·L-1·min-1
C. v (SO3)="0.1" mol·L-1·s-1D. v (O2)=0.1mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
一 | ① | ||||||
二 | ② | ③ | ④ | ⑤ | ⑥ | ||
三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
四 | ⑾ | ⑿ | ⒀ | ||||
(1) 表中元素______的非金属性最强;元素______的金属性最强;元素______的单质室温下呈液态(填写元素符号);
(2) 表中元素⑿的原子结构示意图是___________;
(3) 表中元素⑤在周期表中的位置为____________________;
(4) 表中元素⑨和⑩最高价氧化对应水化物的酸性:__________>__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 叫狄尔斯阿德而反应,用于构建六元环,则下列说法不正确的是
叫狄尔斯阿德而反应,用于构建六元环,则下列说法不正确的是
A. 狄尔斯阿德而反应为加成反应,原子利用率为100%
B. ![]() 可通过狄尔斯阿德而反应合成,而
可通过狄尔斯阿德而反应合成,而 不可通过狄尔斯阿德而反应合成
不可通过狄尔斯阿德而反应合成
C. 2-甲基-1,3-丁二烯和丙炔发生上述反应产物有两种
D. ![]() 可由环戊二烯与丙烯酸甲酯发生上述反应得到
可由环戊二烯与丙烯酸甲酯发生上述反应得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了如下装置用于制取SO2和验证SO2的性质。
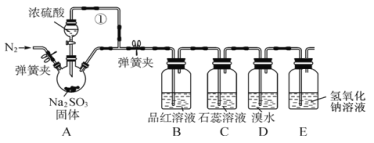
试回答以下问题:
(1)装置A 中用于添加浓硫酸的仪器名称为____,其中反应的化学方程式为________。
(2)导管①的作用是________。
(3)装置D中可观察到的现象是_______,体现出 SO2 ______性。
(4)E装置的作用是_______,发生反应的离子方程式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com