
| A. | Zn为正极 | B. | 负极反应式:O2+4H++4e-→2H2O | ||
| C. | 正极发生氧化反应 | D. | 电解液肯定不是强酸 |
科目:高中化学 来源: 题型:选择题
| A. | n+11 | B. | n+1 | C. | n+3 | D. | n+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
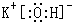 (填写电子式);
(填写电子式);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18.9 g HNO3 | B. | 3.612×1024个HCl分子 | ||
| C. | 0.2 mol H3PO4 | D. | 0.2 NA个CH4分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液pH由大变小 | B. | 负极附近Zn2+浓度逐渐增大 | ||
| C. | H+向负极移动 | D. | 溶液中H2SO4的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com