
| 0.448L |
| 22.4L/mol |
| 2.12g |
| 9g |
| 8.775g |
| 58.5g/mol |
|
| 5.85g |
| 9g |
| 1.03g |
| 9g |


科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L CHCl3中含有的氯原子数目为3NA |
| B、7 g CnH2n中含有的氢原子数目为NA |
| C、18 g D2O中含有的质子数目为10 NA |
| D、1 L 0.5 mol?L-1Na2CO3溶液中含有的CO32-数目为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
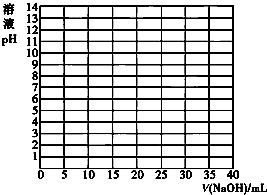 酸碱中和滴定常用于测定酸碱溶液的浓度.
酸碱中和滴定常用于测定酸碱溶液的浓度.| V/(NaOH)/mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| 溶液pH | 2.87 | 4.74 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 | 12.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
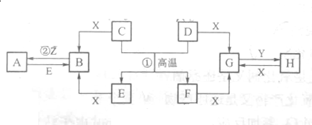 已知D、E、Z是单质,其他都是化合物.D既能与强酸反应,又能与强碱反应;潮湿的Z有漂白性;Y的焰色反应显黄色.除反应①外,其他反应均在水溶液中进行,转化关系如图所示(部分物质条件已略去).
已知D、E、Z是单质,其他都是化合物.D既能与强酸反应,又能与强碱反应;潮湿的Z有漂白性;Y的焰色反应显黄色.除反应①外,其他反应均在水溶液中进行,转化关系如图所示(部分物质条件已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
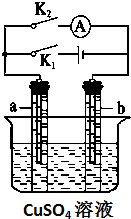 如图所示,某同学按照图装置进行如下实验,请回答下列问题:
如图所示,某同学按照图装置进行如下实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
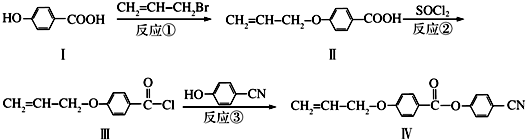
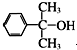 也可与Ⅲ发生类似反应③的反应生成有机物V.V的结构简式是
也可与Ⅲ发生类似反应③的反应生成有机物V.V的结构简式是查看答案和解析>>
科目:高中化学 来源: 题型:
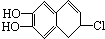 分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是( )
分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是( )| A、1mol、2mol |
| B、2mol、3mol |
| C、3mol、2mol |
| D、3mol、3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
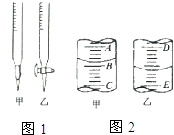 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.02 | 20.00 |
| 2 | 0.10 | 22.00 | 20.00 |
| 3 | 0.10 | 21.98 | 20.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com