
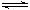 2SO3(g) △H=-197kJ/mol。在25℃时,向恒压密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量a1;若25℃时在此恒压密闭容器中只通入1 mol SO2和0.5 mol O2,达到平衡时放出热量a2。则下列关系正确的是
2SO3(g) △H=-197kJ/mol。在25℃时,向恒压密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量a1;若25℃时在此恒压密闭容器中只通入1 mol SO2和0.5 mol O2,达到平衡时放出热量a2。则下列关系正确的是| A.2a2=a1="197" kJ | B.197 kJ> a1=2a2 |
| C.a2>a1>197 kJ | D.2a2<a1<197 kJ |
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源:不详 题型:单选题
 2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是| A.降温 | B.减压 | C.减少E的浓度 | D.加压 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | A | B | C | D |
| SO3 | 1 mol | 3 mol | 3 mol | 0 mol |
| SO2 | 2 mol | 1.5 mol | 0 mol | 6 mol |
| O2 | 2 mol | 1 mol | 0 mol | 5 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 z C(g),平衡时测得A的浓度为 0.5 mol/L,保持温度不变,将容器的容积压缩到原来的1/2,再达平衡时测得A的浓度为 0.8mol/L,下列判断正确的是( )
z C(g),平衡时测得A的浓度为 0.5 mol/L,保持温度不变,将容器的容积压缩到原来的1/2,再达平衡时测得A的浓度为 0.8mol/L,下列判断正确的是( )| A.x+y ﹤z | B.平衡向正反应方向移动 |
| C.B的物质的量增大 | D.C的体积分数保持不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 HX(g)的平衡常数为10。若将1.0 mol的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
HX(g)的平衡常数为10。若将1.0 mol的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )| A.5% | B.17% | C.25% | D.33% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g) + H2(g);△H=" -Q" kJ·mol-1(Q>0)。已知达到平衡时,CO为0.12mol。试回答:
CO(g) + H2(g);△H=" -Q" kJ·mol-1(Q>0)。已知达到平衡时,CO为0.12mol。试回答:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 SiF4(g)+ 2H2O(g) △H =-148.9 kJ·mo1-1
SiF4(g)+ 2H2O(g) △H =-148.9 kJ·mo1-1查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 4NH3(g)+3O2(g) △H =" a" kJ.mol-1
4NH3(g)+3O2(g) △H =" a" kJ.mol-1| 温度T/K | 303 | 313 | 323 |
| NH3生成量/(10—6mol) | 4.8 | 5.9 | 6.0 |
 g)
g) 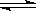 3NH3(g) △H =" —92.4" kJ.mol-1
3NH3(g) △H =" —92.4" kJ.mol-1 2N2(g) + 6H2O(l)
2N2(g) + 6H2O(l) 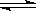 4NH3(g) + 3O2(g)△H = _________。(3分)
4NH3(g) + 3O2(g)△H = _________。(3分)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
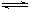 nZ(g)+R(g)达到平衡时,若将反应混合气体中各物质浓度均增大一倍,X的转化率不变,已知t℃时该反应的K=1,则X的转化率为
nZ(g)+R(g)达到平衡时,若将反应混合气体中各物质浓度均增大一倍,X的转化率不变,已知t℃时该反应的K=1,则X的转化率为| A.80% | B.65% | C.45% | D.37% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com