
| A. | 氢氧化钡溶液和硫酸钠溶液混合:Ba2++SO42-=BaSO4↓ | |
| B. | 将亚硫酸氢钠加入盐酸溶液中:HSO3-+H+=SO2↑+H2O | |
| C. | 氢硫酸与亚硫酸混合:H2SO3+2H2S=3S↓+3H2O | |
| D. | H2S气体通入CuSO4溶液中:Cu2++S2-=CuS↓ |
分析 A.二者反应实质钡离子与硫酸根离子反应生成硫酸钡沉淀;
B.二者反应生成氯化钠、水、二氧化硫;
C.二者发生氧化还原反应生成硫单质和水;
D.硫化氢为弱酸,应保留化学式.
解答 解:A.氢氧化钡溶液和硫酸钠溶液混合,离子方程式:Ba2++SO42-=BaSO4↓,故A正确;
B.将亚硫酸氢钠加入盐酸溶液中,离子方程式:HSO3-+H+=SO2↑+H2O,故B正确;
C.氢硫酸与亚硫酸混合,化学方程式:H2SO3+2H2S=3S↓+3H2O,故C正确;
D.H2S气体通入CuSO4溶液中,离子方程式:Cu2++H2S=CuS↓+2H+,故D错误;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意化学式拆分,题目难度不大.


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 30gSiO2晶体中含有NA个硅氧键 | |
| B. | 常温常压下,11.2LCl2含有的分子数目少于0.5NA | |
| C. | 25℃时,pH=12的NaOH溶液含有的OH-数目为0.01NA | |
| D. | 50mL18.4mol/L浓硫酸与足量铜微热,生成SO2分子的数目为0.46NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 试剂a | 试剂b | 试剂c | 装置 |
| A | 验证非金属性:S>C>Si | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 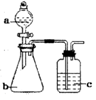 |
| B | 制备纯净的氯气 | 浓盐酸 | MnO2 | 饱和食盐水 | |
| C | 检验溶液X 中含有CO32- | 盐酸 | 溶液X | 澄清石灰水 | |
| D | 除去Na2SO3 中的Na2SO4 | 氯水 | 混合物 | NaOH 溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ | B. | SO42- | C. | Ba2+ | D. | NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氯较氯水的漂白作用更强 | B. | 液氯与氯水均有酸性 | ||
| C. | 液氯是纯净物,氯水是混合物 | D. | 液氯是无色的,氯水呈黄绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4HNO3$\frac{\underline{\;光照\;}}{\;}$2H2O+4H2O↑+O2↑ | B. | NaOH+HCl═NaCl+H2O | ||
| C. | CaCO3+2HCl═CaCl2+CO2↑+H2 | D. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2通入BaCl2溶液中无现象,加入氨水后得到BaSO4沉淀 | |
| B. | SO2通入酸性KMnO4溶液中,溶液褪色,体现SO2的漂白性 | |
| C. | SO2通入紫色石蕊试液中,溶液变红色 | |
| D. | 等物质的量的SO2和Cl2通入水中,溶液的漂白性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2CO3和K2O都属于钾盐 | B. | H2SO4和HNO3都属于酸 | ||
| C. | KOH和Na2CO3都属于碱 | D. | Na2O和Na2CO3都属于氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的氯气的物质的量为6a mol | |
| B. | 改变温度,产物中NaCl的最小理论产量为4a mol | |
| C. | 改变温度,反应中转移电子的物质的量n的范围:3a mol≤n≤5a mol | |
| D. | 某温度下,若反应后$\frac{{c(C{l^-})}}{{c(Cl{O^-})}}$=6,则溶液中$\frac{{c(C{l^-})}}{c(ClO_3^-)}=\frac{1}{2}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com