
| A. | 汽车排放的尾气 | B. | 硫酸厂尾气 | C. | 居室装修废气 | D. | 卤代烃挥发 |
科目:高中化学 来源: 题型:选择题
| A. | 用氢氟酸来刻蚀玻璃:SiO2+4H++4F-═SiF4↑+2H2O | |
| B. | 用石墨电极电解AlCl3溶液:2Al3++6H2O═2Al(OH)3↓+3H2↑ | |
| C. | 铅蓄电池放电时的反应:Pb+PbSO4+4H++SO42-═2Pb2++SO42-+2H2O | |
| D. | 酸性高锰酸钾溶液与草酸反应:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
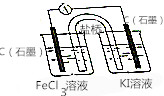 按如图所示装置(盐桥内含有KCl饱和溶液)线路连接后,可发现电流表指针明显偏转,说明发生了原电池反应,下列关于该电池的叙述正确的是( )
按如图所示装置(盐桥内含有KCl饱和溶液)线路连接后,可发现电流表指针明显偏转,说明发生了原电池反应,下列关于该电池的叙述正确的是( )| A. | 左侧石墨为电池的正极,电极反应:Fe3++e-═Fe2+ | |
| B. | 右侧烧杯中发生还原反应,电极反应:2I--2e-═I2 | |
| C. | 右侧烧杯内溶液颜色变浅 | |
| D. | 盐桥中的K+流向右侧烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
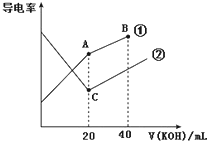
| A. | A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)═0.1mol•L-1 | |
| B. | B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) | |
| C. | C点水电离的c(OH-)大于A点水电离的c(OH-) | |
| D. | A、B、C三点溶液均有Kw=c(H+)•c(OH-)=1.0×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.
2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
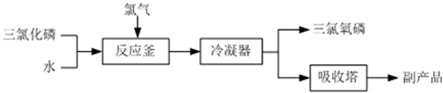
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
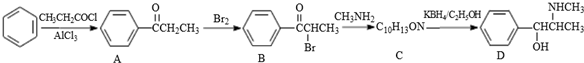
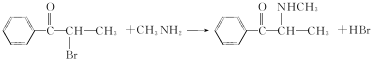 .C-D的反应类型为还原反应.
.C-D的反应类型为还原反应.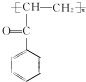 .
. (写结构简式).
(写结构简式).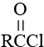 .参照上述合成路线,设计一条由苯和乙酸为起始原料制备
.参照上述合成路线,设计一条由苯和乙酸为起始原料制备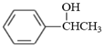 的合成路线:
的合成路线: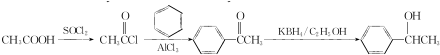 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 | |
| B. | 乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键 | |
| C. | 丙中含有第2周期ⅣA 族的元素,则丙可能是甲烷的卤代物 | |
| D. | 丁和甲中各元素质量比相同,则丁可能是C2H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com