

| A. | 氧元素的质量数是16 | |
| B. | 氧元素的相对原子质量是16.00 | |
| C. | 氧原子2p亚层有一个未成对电子 | |
| D. | 氧原子最外层有6个能量相同的电子 |
分析 A.元素一般不谈质量数,原子谈质量数,原子质量数=质子数+中子数;
B.由图可知,氧元素的相对原子质量为16.00;
C.2p亚层有3个轨道,容纳4个电子,每个轨道容纳2个电子且自旋方向相反,电子优先占据一个轨道;
D.s能级与p能级的能量不同,同一能级中电子能量相同.
解答 解:A.元素一般不谈质量数,原子谈质量数,且氧原子中子数未知,故氧原子质量数也不能确定,故A错误;
B.由图可知,氧元素的相对原子质量为16.00,故B正确;
C.2p亚层有3个轨道,容纳4个电子,根据泡利原理、洪特规则可知,2p亚层电子排布图为 ,有2个未成对电子,故C错误,
,有2个未成对电子,故C错误,
D.氧原子最外层6个电子的能量并不都相同,s能级2个电子能量相同,p能级4个电子能量相同,故D错误,
故选:B.
点评 本题考查元素周期表、核外电子排布规律,比较基础,注意对基础知识的理解掌握.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
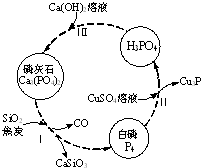 磷及部分重要化合物的相互转化如图所示.
磷及部分重要化合物的相互转化如图所示.| 成分 | CaO | P2O5 | SO3 | CO2 |
| 质量分数(%) | 47.30 | 28.40 | 3.50 | 6.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | S2-+Cu2+→CuS↓ | B. | 2HS-+Cu2+→CuS↓+2H++S2- | ||
| C. | HS-+Cu2+→CuS↓+H+ | D. | 2HS-+Cu2+→CuS↓+H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
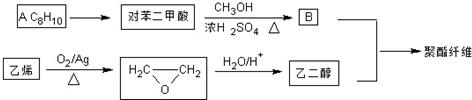
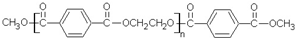 若乙二醇过量,则生成的聚酯纤维可表示为
若乙二醇过量,则生成的聚酯纤维可表示为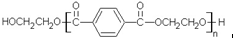 .
.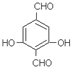 .
. 合成PC的2种单体的中:醇(或酚)的结构简式为
合成PC的2种单体的中:醇(或酚)的结构简式为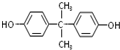 ,酯的名称为碳酸二苯酚酯.
,酯的名称为碳酸二苯酚酯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b | B. | HA与BOH的电离常数相等 | ||
| C. | 混合溶液中,c(H+)=$\sqrt{{K}_{W}}$mol/L | D. | 混合溶液中,c(H+)+c(B+)═c(OH-)+c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 1molN≡N键能与3molH-H键能之和大于6molN-H键能,所以反应为放热 | |
| B. | N2(g)+3H2(g)?2NH3(l)+Q2反应历程的能量变化如曲线Ⅱ,则Q2>Q1 | |
| C. | 选择合适的催化剂,可以降低反应所需温度,Q1值也相应减少 | |
| D. | 2mol氨气的能量高于1mol氮气和3mol氢气的能量之和,所以反应需要高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是极性分子 | |
| B. | 都是共价化合物 | |
| C. | 共价分子间的作用力都比化学键弱 | |
| D. | 溶于水的共价分子都能产生自由移动的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
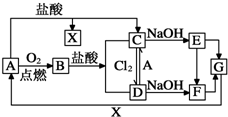
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com