
| A. | 反应物的总能量大于生成物的总能量 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 应用盖斯定律,可计算出某些难以直接测量的反应的焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
分析 A.化学反应分为吸热反应和放热反应,要看是吸热反应还是放热反应;
B.根据化学反应速率的影响因素分析;
C.根据盖斯定律含义结合应用进行解答;
D.反应的焓变只和反应物生成物的能量有关,与反应途径、条件无关.
解答 解:A.若是放热反应,反应物的总能量大于生成物的总能量,若为吸热反应,反应物的总能量小于生成物的总能量,故A错误;
B.化学反应速率与吸热反应还是放热反应无关,故B错误;
C.盖斯定律是指一个反应若可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同与反应的途径无关,应用盖斯定律,可计算某些难以直接测量的反应的焓变,如利用盖斯定律计算C不完全燃烧生成CO的焓变,故C正确;
D.△H=Q(生成物的能量和)-Q(反应物的能量和),与反应途径、反应条件无关,故D错误;
故选C.
点评 本题考查热效应的含义的理解,理解并掌握盖斯定律的应用是解答本题的关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 食盐中阴离子的结构示意图为  | |
| B. | 氧化亚铁溶于足量稀硝酸的离子方程式:FeO+2H+=Fe2++H2O | |
| C. | NaHS水解的离子方程式:HS-十H20?H3O++S2- | |
| D. | 用惰性电极电解氯化钠溶液,阳极电极反应式:2Cl--2e-=Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料.已知
甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料.已知查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
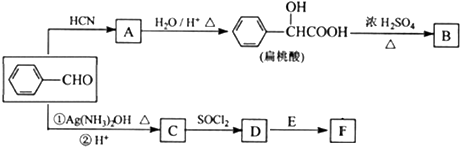

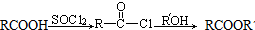 (R、Rˊ代表烃基)
(R、Rˊ代表烃基)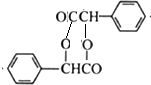 ,化合物C中的含氧官能团的名称是羧基.
,化合物C中的含氧官能团的名称是羧基. .
.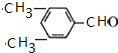 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com