
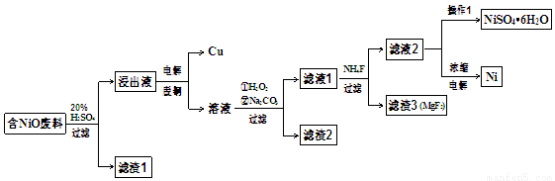
(15分)某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如下:
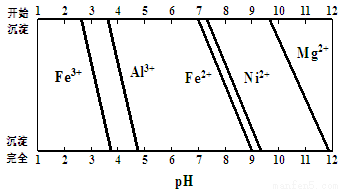
已知:有关金属离子生成氢氧化物沉淀所需的pH如下图:
(1)滤渣1的主要成分为 。
(2)电解脱铜:金属铜在 极析出。
(3)①用离子方程式解释加入H2O2的作用 。
②加Na2CO3调节溶液的pH至5,则滤渣2的主要成分为 。
(4)从滤液2中获得NiSO4.6H2O的实验操作是 、过滤、洗涤、干燥。
(5)电解浓缩后的滤液2可获得金属镍,其基本反应原理示意图如下:
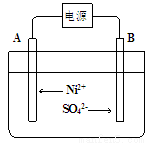
①A极的电极反应式为 和2H++2e-=H2↑。
②B极附近pH会 (填“增大”、“减小”或“不变”);用平衡移动原理解释B极附近pH变化的原因: 。
③若一段时间后,在A、B两极均收集到11.2L气体(标准状况下),理论上能得到Ni g。
(1)SiO2(1分);(2)阴(1分);
(3)①2H+ +H2O2 + 2Fe2+= 2Fe3++ 2H2O;②Fe(OH)3、Al(OH)3(答出1个给1分)
(4)加热浓缩、冷却结晶
(5)①Ni2++2e-===Ni ;②减小(1分)
H2O H++OH-,OH-在B极放电使c(OH-)降低,平衡向右移动,c(H+)增大,导致pH降低
H++OH-,OH-在B极放电使c(OH-)降低,平衡向右移动,c(H+)增大,导致pH降低
③29.5
【解析】
试题分析:(1)某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用稀硫酸处理,金属氧化物与酸反应产生相应的硫酸盐,而酸性氧化物SiO2不能发生反应,以固体形式存在,所以得到的炉渣成分是SiO2;(2)电解含有各种金属阳离子的溶液,由于离子放电能力:Cu2+>H+>Fe2+>Al3+>Mg2+,所以在阴极Cu2+得到电子,被还原为金属Cu。(3)①由于Fe2+、Ni2+形成沉淀的溶液的pH接近,不容易把杂质Fe2+除去,而Fe3+完全沉淀时溶液的pH小于4,可以很好的除去,所以加入H2O2的目的就是将Fe2+氧化为Fe3+除去。用离子方程式表示是2H+ +H2O2 + 2Fe2+= 2Fe3++ 2H2O;②加Na2CO3调节溶液的pH至5,根据图像可知形成的沉淀是Fe(OH)3、Al(OH)3,所以滤渣2的主要成分为Fe(OH)3、Al(OH)3。(4)从滤液2中获得NiSO4.6H2O的实验操作是加热浓缩、冷却结晶、过滤、洗涤、干燥。(5)①根据同种电荷相互排斥,异种电荷相互吸引的原则,A极为阴极。该电极的电极反应式为Ni2++2e-===Ni和2H++2e-=H2↑。②B极为阳极,反应反应:OH—-4e-=2H2O+O2↑。由于OH—不断放电,使附近溶液中c(H+)增大,所以pH会减小。用平衡移动原理解释B极附近pH变化的原因:H2O H++OH-,OH-在B极放电使c(OH-)降低,平衡向右移动,c(H+)增大,导致pH降低。③在整个闭合回路中电子转移的物质的量相等。2×n(Ni)+2×n(H2)=4×n(O2)。2×n(Ni)+ 2×0.5=4×0.5,n(Ni)= 0.5mol.则m(Ni)= 0.5mol×59g/mol=29.5g。
H++OH-,OH-在B极放电使c(OH-)降低,平衡向右移动,c(H+)增大,导致pH降低。③在整个闭合回路中电子转移的物质的量相等。2×n(Ni)+2×n(H2)=4×n(O2)。2×n(Ni)+ 2×0.5=4×0.5,n(Ni)= 0.5mol.则m(Ni)= 0.5mol×59g/mol=29.5g。
考点:考查用NiO的废料提取NiSO4和Ni的流程的知识。主要包括混合物的分离、反应条件的控制、离子方程式的书写、电化学的应用、物质质量的计算的知识。
考点分析: 考点1:电解池 考点2:物质的分离、除杂和提纯 考点3:物质的检验和鉴别 试题属性

科目:高中化学 来源:2014-2015学年福建省泉州五校高三上学期摸底联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.酸、碱、盐都是电解质 B.电解质都是易溶于水的物质
C.氧化物都是电解质 D.氢化物都不是电解质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市石景山区高三上学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.HOCH2COOH的缩聚物是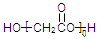
B.乙醛和丙烯醛( )不是同系物
)不是同系物
C.已知甲醛分子中各原子共平面,则丙烯醛所有原子一定共平面
D.结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子的单体是1,3-丁二烯
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省商丘市高三第一次模拟考试化学试卷(解析版) 题型:选择题
下列各表述与示意图不一致的是
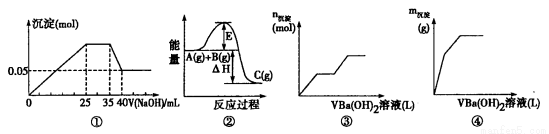
A.图①表示向含Mg2+、Al3+、 的盐溶液中滴加NaOH溶液时,沉淀的物质的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+) :n(Al3+) :n(
的盐溶液中滴加NaOH溶液时,沉淀的物质的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+) :n(Al3+) :n( )=2 :1 :2,其中使用的NaOH的浓度为2 mol·L-1。
)=2 :1 :2,其中使用的NaOH的浓度为2 mol·L-1。
B.图②中曲线表示某反应过程的能量变化,当物质A(g)与B(g)反应生成物质C(g)时,△H<0,若使用正催化剂,E值会减小。
C.图③可用来表示向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系图
D.图④表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的质量(m)与加入Ba(OH)2溶液体积(V)之间的关系图
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省商丘市高三第一次模拟考试化学试卷(解析版) 题型:选择题
A、B、C、X均为中学化学常见的物质,一定条件下,它们有如下转化关系(部分产物已略去),下列说法错误的是

A.若X为Cl2,则C可能为FeCl3
B.若X为KOH溶液,则A可能为AlCl3溶液
C.若X为O2,则A可能为H2S或NH3
D.若A、B、C均为焰色反应呈黄色的化合物,则X可能为CO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三年级3月适应性训练理综化学试卷(解析版) 题型:选择题
下述实验方案不能达到实验目的的是
编号 | A | B | C | D |
实验 方案 |
|
|
片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 |
2mL0.1mol·L-1NaCl溶液 ① 加入3滴同浓度的AgNO3溶液再加入3滴同浓度的Na2S溶液 |
目的 | 验证乙炔的还原性 | 收集氨气 | 验证Fe电极被保护 | 验证AgCl的溶解度 大于Ag2S |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省枣庄市高三下学期开学初检测试卷理综化学试卷(解析版) 题型:实验题
(19分)根据侯德榜提出的工艺,制碱厂设计生产流程如下:

(1)该流程中可循环利用的物质是 。向母液中通氨气,并加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(2)检验产品纯碱中是否含有NaCl的试剂是 。
(3)某学习小组在实验室模拟制碱有关工艺。
①若利用氯化铵和熟石灰制取氨气,反应方程式是 ,制得的氨气可用下列盛有NaCl溶液的 装置吸收。

②已知用饱和NaNO2与NH4C1溶液加热可制取氮气。该小组模拟工业合成氨设计如下装置:

仪器a的名称是 ;氢气的发生装置应选用 ;A装置加热片刻后,即应移去酒精灯以防反应物冲出,其原因是 。装置D的作用是①除去N2、H2中的水;② ;③观察并调节气泡速率,控制N2、H2的比例。
有同学认为:从氨合成器(E装置)中出来的气体连续通入F装置的NaCl溶液中,可能会发生倒吸。你认为是否可能并说明理由 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省文登市高三第二次统考理科综合化学试卷(解析版) 题型:选择题
下列关于离子的叙述正确的是
A.在c(H+)=1×10-13mol·L-1的溶液中:Na+、Fe3+、Cl-、SO42-能大量共存
B.铜溶于FeCl3溶液中:Cu + Fe3+ = Fe2+ + Cu2+
C.NaHCO3溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D.向溶液中加入BaCl2溶液后再加盐酸,有白色沉淀,说明该溶液中一定含有SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省烟台市高三下学期一模诊断测试理科综合化学试卷(解析版) 题型:填空题
(12分)【化学—化学与技术】
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。

(1)工业上采用电解氧化铝和冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:2Al2O3 4Al+3O2↑。
4Al+3O2↑。
加入冰晶石的作用为_______________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为________,下列可作阴极材料的是______。
a.铝材 b.石墨 c.铅板 d.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式_______________________。在铝阳极氧化过程中,需要不断地调整电压,理由是_________________。
(4)下列说法正确的是__________________。
a.阳极氧化是应用原电池原理进行金属材料表面处理的技术
b.铝的阳极氧化可增强铝表面的绝缘性能
c.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
d.铝的阳极氧化膜富多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com