
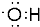 ;二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为:
;二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为: ;丁烷的同分异构体为异丁烷,其结构简式为:CH3CH(CH3)2,
;丁烷的同分异构体为异丁烷,其结构简式为:CH3CH(CH3)2, ;
; ;CH3CH(CH3)2;
;CH3CH(CH3)2;| 催化剂 |
| △ |
| 催化剂 |
| △ |
 ,该反应为取代反应,
,该反应为取代反应, ;取代反应.
;取代反应.


科目:高中化学 来源: 题型:
| A、Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度 |
| B、沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 |
| C、在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大 |
| D、沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知原子序数依次增大的A、B、C、D、E五种元素中有2种为非金属元素,其原子序数均小于30.其中A、B、C、E的价电子层中均有2个未成对电子,A、B同族且可以形成原子个数比为1:1的化合物BA,属于原子晶体.回答下列问题:
已知原子序数依次增大的A、B、C、D、E五种元素中有2种为非金属元素,其原子序数均小于30.其中A、B、C、E的价电子层中均有2个未成对电子,A、B同族且可以形成原子个数比为1:1的化合物BA,属于原子晶体.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
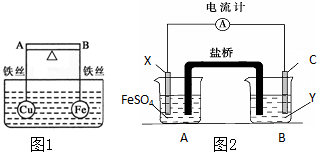 (1)如图1所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央滴入浓硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)当杠杆为绝缘体时,A端比B端
(1)如图1所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央滴入浓硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)当杠杆为绝缘体时,A端比B端查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2N2H4(g)+2NO2(g)═3 N2(g)+4 H2O(l);△H═-1135.7kJ/mol |
| B、2N2H4(g)+2NO2(g)═3 N2(g)+4 H2O(g);△H═-1000.3kJ/mol |
| C、N2H4(g)+NO2(g)═3/2 N2(g)+2 H2O(l);△H═-1135.7kJ/mol |
| D、2N2H4(g)+2NO2(g)═3 N2(g)+4 H2O(g);△H═-1135.7kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(OH)2溶液中加入少量KAl(SO4)2溶液:3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓ |
| B、FeCl3溶液中加入Cu粉:Fe3++Cu=Fe2++Cu2+ |
| C、将适量SO2通入Ca(ClO)2溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| D、向a mol FeBr2溶液中通入1.5amolCl2:2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com