
| A. | 液氯是纯净物,氯水是电解质,漂白粉是混合物 | |
| B. | 氯气可用作消毒剂和漂白剂,是因为氯分子具有强氧化性 | |
| C. | 随着化合价的升高,氯的含氧酸酸性和氧化性均逐渐增强 | |
| D. | 不能用pH试纸测定氯水的pH |
分析 A.氯水为混合物,而电解质必须为化合物;
B.干燥的氯气不具有漂白性;
B.随着化合价的升高,氯的含氧酸酸性增强,氧化性逐渐减弱;
D.氯水中HClO具有漂白性.
解答 解:A.氯水为混合物,而电解质必须为化合物,则氯气不是电解质,而液氯是纯净物,漂白粉(主要成分为氯化钙和次氯酸钙)是混合物,故A错误;
B.干燥的氯气不具有漂白性,氯气具有强氧化性,氯气可用作消毒剂,故B错误;
B.随着化合价的升高,非羟基氧原子个数增多,则氯的含氧酸酸性增强,而氧化性逐渐减弱,故C错误;
D.氯水中HClO具有漂白性,则不能用pH试纸测定氯水的pH,故D正确;
故选D.
点评 本题考查含氯物质的性质,为高频考点,把握氯气的性质、性质与用途等为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | C12H20O6 | B. | C15H26O6 | C. | C18H32O6 | D. | C21H38O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
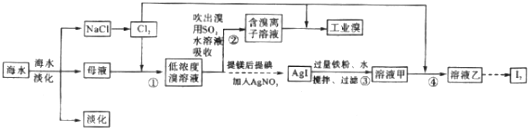
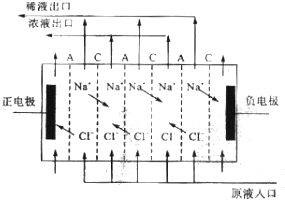
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④③①⑤ | B. | ②③①④⑤ | C. | ②④③⑤① | D. | ②⑤③①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na.Mg、Al还原性依次减弱 | B. | I2、Br2、Cl2氧化性依次增强 | ||
| C. | 原子半径:F<Mg<K | D. | 稳定性:PH3>H2S>HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al的第一电离能逐渐增大 | B. | 热稳定性:HF>H2O>NH3 | ||
| C. | S2-、Cl-、K+的半径逐渐增大 | D. | O、F、Ne的电负性逐渐增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com