
【题目】氧化还原反应是中学化学中常见且重要的一类反应,回答下列问题:
(1)下列金属单质参加的化学反应都是氧化还原反应,都是金属失电子。
①相同质量的钠分别与氧气反应,全部生成氧化钠和全部生成过氧化钠两种情况下转移的电子数目之比是________;
②分别取W克钠、铁、铝与足量的盐酸反应,失去电子的物质的量之比是________;③分别取含0.1mol H2SO4的稀硫酸和含0.1mol NaOH的氢氧化钠溶液于两支试管中,分别加入足量的铝粉充分反应,产生氢气 (同温同压下)的体积之比是________。
(2)某氧化还原反应的反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2转化为氧气。
①该反应中的还原剂是____________;
②如果化学方程式中Cr(OH)3和H2O2的物质的量之比为2:3,写出该反应的化学方程式,并标出电子转移的方向和数目_________________;
③如果反应中转移了3a mol电子,则产生的气体在标准状况下体积为______L。
【答案】1∶1 1/23:1/28:1/9 2∶3 H2O2 ![]() ===2Cr(OH)3↓+3O2↑+2H2O 33.6a L
===2Cr(OH)3↓+3O2↑+2H2O 33.6a L
【解析】
(1)①钠与氧气反应,无论是生成氧化钠,还是过氧化钠,其中钠元素都是+1价。
②根据Na→Na+,Fe→Fe2+,Al→Al3+来解答。
③根据2Al+ 6H+= 2Al3++ 3H2↑,2Al + 2OH-+ 2H2O=2AlO2-+ 3H2↑来解答。
(2)①H2O2转化为氧气,O元素的化合价由-1价升高为0价,则H2O2为还原剂。
②H2O2转化为氧气,O元素的化合价由-1价升高为0价,有元素化合价升高,必有元素化合价降低,从题给物质可看出化合价降低的元素是Cr。
③根据方程式2H2CrO4+3H2O2=2Cr(OH)3↓+3O2↑+2H2O来解答。
(1)①钠与氧气反应,无论是生成氧化钠,还是过氧化钠,其中钠元素都是+1价,相同质量的钠分别与氧气反应,全部生成氧化钠和全部生成过氧化钠两种情况下转移的电子数目之比是1:1,故答案为:1:1。
②W克钠、铁、铝的物质的量分别为:W/23mol,W/56mol,W/27mol,Na→Na+,Fe→Fe2+,Al→Al3+,与足量的盐酸反应,失去电子的物质的量之比是W/23mol:W/56mol×2:W/27mol×3=1/23:1/28:1/9,故答案为:1/23:1/28:1/9。
③铝粉和H2SO4反应的离子方程式为:2Al+ 6H+= 2Al3++ 3H2↑,
0.2mol 0.1mol
铝粉和氢氧化钠溶液反应的离子方程式为:2Al + 2OH-+ 2H2O=2AlO2-+ 3H2↑,
0.1mol 0.15mol
同温同压下,气体的体积比等于物质的量之比,故体积之比是2:3。
故答案为:2:3。
(2)①H2O2转化为氧气,O元素的化合价由-1价升高为0价,则H2O2为还原剂,故答案为:H2O2;
②H2O2转化为氧气,O元素的化合价由-1价升高为0价,有元素化合价升高,必有元素化合价降低,从题给物质可看出化合价降低的元素是Cr,发生还原过程的是H2CrO4→Cr(OH)3,已知化学方程式中Cr(OH)3和H2O2的物质的量之比为2:3,根据得失电子守恒配平该氧化还原反应的化学方程式为:2H2CrO4 +3H2O2==2Cr(OH)3↓+3O2↑+2H2O,并标出电子转移的方向和数目:![]() ==2Cr(OH)3↓+3O2↑+2H2O,故答案为:
==2Cr(OH)3↓+3O2↑+2H2O,故答案为:![]() =2Cr(OH)3↓+3O2↑+2H2O。
=2Cr(OH)3↓+3O2↑+2H2O。
③根据方程式可以看出当转移6mol电子时,生成氧气为3mol,如果反应中转移了3a mol电子,生成氧气为1.5amol,在标准状况下体积为33.6a L,故答案为:33.6a L。


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】“绿色化学实验”已走近课堂,下列做法符合“绿色化学”理念的是

①实验室收集氨气采用图甲所示装置
②实验室中做氯气与钠反应的实验时采用图乙所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与HCl反应生成铵盐的实验
④实验室中采用图丙所示装置进行铜与稀硝酸的反应
A. ②③④ B. ①②③
C. ①②④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于常温下pH=3的CH3COOH溶液,下列叙述不正确的是( )
A. c(H+)= c(CH3COO-)+ c(OH-)
B. 加入少量CH3COONa固体后,c(CH3COO-)降低
C. 该溶液中由水电离出的c(H+)是1.0×10-11mol/L
D. 与等体积pH =11的NaOH溶液混合后溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
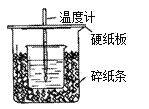
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________。
(2)烧杯间填满碎纸条的作用是_______________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填“偏大、偏小、无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1的盐酸跟50 mL 0.55 mol·L-1的NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热_____________ (填“相等”或“不相等”)。
(5)此反应中和热的热化学方程式为:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案合理的是( )
A. 可用酸性高锰酸钾溶液除去甲烷中混有的杂质乙烯
B. 可用溴水鉴别己烯、己烷和四氯化碳
C. 制备氯乙烷:将乙烷和氯气的混合气放在光照条件下反应
D. 证明溴乙烷与NaOH醇溶液共热生成了乙烯:用如图所示的实验装置

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中不正确的是( )
A. 一定条件下,将1g乙炔溶于12g苯,所得混合物中含有的碳原子数为NA
B. l04g苯乙烯(C6H5-CH=CH2)中含有8NA个碳氢键和NA个碳碳双键
C. 在100g质量分数为46%的乙醇水溶液中,含有氢原子数为6NA
D. lmol有机物CH3-CH=CH-CH3中最多有8NA个原子在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐[(NH4)2Fe(SO4)2·6H2O]是一种重要的化工原料,可用于制取纳米Fe3O4和草酸合铁酸钾等。
(1)取一定质量摩尔盐样品与过量NaOH溶液反应。
①根据生成气体的体积计算得到摩尔盐的纯度小于实际值,其原因是______。
②向所得Fe(OH)2沉淀中加入NaNO2溶液可制得纳米Fe3O4,同时产生NO。该反应的离子方程式为______。
(2)摩尔盐经氧化后与KOH和H2C2O4反应可得到草酸合铁酸钾[KaFeb(C2O4)c·dH2O],其中Fe元素化合价为+3。
①已知25 ℃,H2C2O4的电离常数Ka1=5.6×10-2,Ka2=5.4×10-5。pH=4的H2C2O4溶液中c(C2O![]() ):c(HC2O)=______。
):c(HC2O)=______。
②为了确定草酸合铁酸钾的组成,准确称取4.910 g样品在氮气气氛下加热,固体样品的剩余质量随温度的变化如图所示。
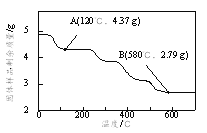
已知:a.120℃时已完全失去结晶水。
b.200℃~580℃分解产生的CO和CO2恢复至标准状况下体积为1.008 L。
c.580℃以上残留固体为FeO和K2CO3的混合物。
根据以上实验数据计算草酸合铁酸钾中的n(Fe3+):n(C2O42-)_____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①氢氧化钠溶液、②铜片、③碳酸钙、④蔗糖、⑤熔融的NaCl、⑥SO2气体、⑦碳酸氢钠、⑧盐酸
(1)能导电且属于电解质的是___________。(填编号)
(2)写出碳酸钙的电离方程式____________________________________。
(3)写出碳酸氢钠与氢氧化钠反应的离子方程式____________________________________。
(4)向100mL1.5mol/L的氢氧化钠溶液中缓慢通入一定量的CO2,反应后,向所得溶液中逐滴缓慢滴加一定浓度的盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示。
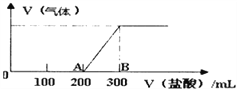
则
①氢氧化钠溶液与一定量的CO2充分反应后的溶液中溶质为_________(写化学式)。
②盐酸的浓度为________________________。
③B点时,产生的气体在标准状况下的体积为_________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是 ,写出一种工业制备单质F的离子方程式 。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为 ,其水溶液与F单质反应的化学方程式为 ;在产物中加入少量KI,反应后加人CC14并振荡,有 机层显 色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A的二元离子化合物 |
b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
c | 化学组成为BDF2 |
d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式为 ;b的化学式为 ;;c的电子式为 ;
d的晶体类型是 。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过 键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com