
 往含0.2mol NaOH和0.1mol Ca(OH)2的混合溶液中持续稳定地通入CO2气体0.5mol.请以CO2的量为横坐标,以溶液中离子的总量为横坐标,画出离子总量随CO2加入量变化的折线图.(不计弱电解质的电离和盐的水解)
往含0.2mol NaOH和0.1mol Ca(OH)2的混合溶液中持续稳定地通入CO2气体0.5mol.请以CO2的量为横坐标,以溶液中离子的总量为横坐标,画出离子总量随CO2加入量变化的折线图.(不计弱电解质的电离和盐的水解) 分析 n(CO2)=0.5mol,通入含有0.2mol氢氧化钠和0.1mol氢氧化钙的溶液中,通入含有0.2molNaOH和0.1molCa(OH)2的溶液中,相当于首先发生:Ca2++2OH-+CO2=CaCO3↓,然后发生2OH-+CO2=CO32-+H2O,再发生CO32-+CO2+H2O=2HCO3-、继续通入反应CaCO3+CO2+H2O=Ca2++2HCO3-,再继续通入二氧化碳溶液中离子物质的量不变,过程中发生的反应为:Ca2++2OH-+CO2=CaCO3↓,2OH-+CO2=CO32-+H2O,OH-+CO2+H2O=2HCO3-,CaCO3+CO2+H2O=Ca2++2HCO3-,以此解答该题.
解答 解:n(CO2)=0.5mol,
含有0.2mol氢氧化钠和0.1mol氢氧化钙的溶液中:n(OH-)=0.2mol+0.1mol×2=0.4mol,n(Na+)=0.2mol,n(Ca2+)=0.1mol,
通入CO2,发生反应的离子方程式:Ca2++2OH-+CO2=CaCO3↓,2OH-+CO2=CO32-+H2O,OH-+CO2+H2O=2HCO3-,CaCO3+CO2+H2O=Ca2++2HCO3-,
通入含有0.2molNaOH和0.1molCa(OH)2的溶液中,相当于首先发生:Ca2++2OH-+CO2=CaCO3↓,该阶段0.1molCa(OH)2完全反应消耗0.1molCO2,离子物质的量减少0.3mol,溶液中离子物质的量为0.7mol-0.3mol=0.4mol,其中含有0.2molOH-、生成0.1molCaCO3;
然后发生2OH-+CO2=CO32-+H2O,0.2molOH-完全反应消耗0.1molCO2,该阶段离子物质的量减少0.1mol,溶液中剩余离子物质的量为0.4mol-0.1mol=0.3mol,溶液中含有0.2molNa+、0.1molCO32-;
再发生CO32-+CO2+H2O=2HCO3-、消耗0.1molCO2,溶液中离子物质的量增大0.1mol,为0.2molHCO3-,0.2molNa+、共0.4mol离子,继续通入反应CaCO3+CO2+H2O=Ca2++2HCO3-,消耗0.1molCO2,溶液中离子物质的量增大0.1moCa2+和0.2molHCO3-,溶液中离子为0.7mol,再继续通入二氧化碳溶液中离子物质的量不变,
依据上述分析得到描点坐标为:(0,0.7)(0.1,0.4)(0.2,0.3)(0.3,0.4)(0.4,0.7)(0.5,0.7),描点画出变化的曲线图象为: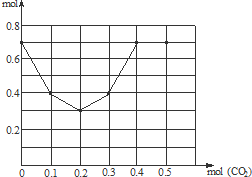
答:离子总量随CO2加入量变化的折线图为: .
.
点评 本题考查离子方程式的计算,题目难度中等,注意根据溶液中发生的反应结合各离子的物质的量计算分析,注意图象中各阶段离子的浓度变化.


科目:高中化学 来源: 题型:选择题
| 选项 | 化学方程式 | 反应类型 |
| A | 4Fe(OH)2+O2+2H2O=4Fe(OH)3 | 化合反应 |
| B | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | 分解反应 |
| C | BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2 | 复分解反应 |
| D | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 | 置换反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
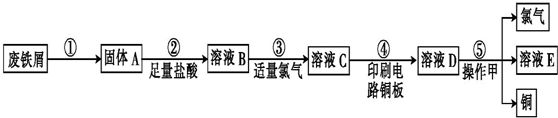
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:C>A | |
| B. | 离子半径:D3+>B2- | |
| C. | 非金属性:A>B | |
| D. | 最高价氧化物对应水化物的碱性:C<D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 只有难溶电解质才存在沉淀溶解平衡过程 | |
| B. | 沉淀溶解平衡过程是可逆的 | |
| C. | 在平衡状态时v溶解=v结晶=0 | |
| D. | 达到沉淀溶解平衡的溶液一定是饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入适量的水 | B. | 适当升高温度 | ||
| C. | 加入少量CuSO4溶液 | D. | 加入等体积的浓度较大的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图为氢气还原氧化铜的微型快速实验装置.实验前先将铜丝1处理成下端弯曲的小圆环,并用铁锤击成带小孔的小匙,将铜丝2一端弯曲成螺旋状.试回答下列问题:
如图为氢气还原氧化铜的微型快速实验装置.实验前先将铜丝1处理成下端弯曲的小圆环,并用铁锤击成带小孔的小匙,将铜丝2一端弯曲成螺旋状.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com